1. 서 론
2. 재료 및 방법
조사 수역과 조사 시기
물리 화학적 환경 자료
총 엽록소 a 농도 및 시아노박테리아의 개체수
DNA Sequencing 분석 및 Clustering
위성 자료 및 RDA 분석
3. 결 과
조사 해역의 계절별 물리 · 화학 환경
총 엽록소 a 농도와 시아노박테리아 개체수
계절별 Cluster의 환경 특성
계절별 시아노박테리아의 다양성
시아노박테리아 clade와 환경 인자의 RDA 분석
4. 토 의
계절별 환경변화에 따른 Synechococcus개체수 분포
대마난류를 통한 Prochlorococcus의 유입
계절별 해양환경에 따른 Synechococcus 다양성
5. 결 론
1. 서 론
시아노박테리아는 2–3 μm 이하인 초미소식물플랑크톤에 속하며, Prochlorococcus와 Synechococcus가 여기에 포함된다. 이들은 해양환경에서 중요한 일차생산자로 알려져 있다(Liu et al. 1997; Li 1994). Prochlorococcus는 생태적 특성에 따라 해양의 넓은 위도 범위에서 나타나며(45°N~ 40°S), 빈 영양 열대 해역에서 높은 개체수를 보인다(Choi et al. 2011; Partensky et al. 1999; Partensky and Garczarek 2010; Scanlan et al. 2009). 이와 달리 Synechococcus는 적도에서 극지까지 널리 분포하며, 용승 해역이나 연안의 중영양 해역에서 높은 개체수를 보인다(Partensky et al. 1999; Zwirglmaier et al. 2007, 2008). 이들은 부피 대비 높은 표면적으로 인하여 낮은 영양염 조건에서 성장에 유리한 이점을 가지고 있어(Litchman et al. 2007), 빈영양 해역에서 높은 우점율을 보여준다(Raven 1998).
과거부터 시아노박테리아의 다양성 연구가 수행되어 오면서, Synechococcus와 Prochlorococcus의 다양한 clade들이 가진 생태적 특성이 밝혀져 왔다(Choi and Noh 2009; Fuller et al. 2006; Huang et al. 2012; Rocap et al. 2002; Toledo and Palenik 1997). 예를 들어, Synechococcus clade I과 IV는 낮은 수온과 높은 영양염을 가진 연안 해역에서 높은 개체수를 보여주며, II와 III은 빈 영양 열대 및 아열대 해역에서 높게 나타난다(Zwirglmaier et al. 2007, 2008). CB1이나 CB5는 강 하구에서 발견되고(Chen et al. 2006; Huang et al. 2012), V, VI 그리고 IX는 연안해역에서 높은 우점율을 보이며 광염성인 것으로 알려져 있다(Choi et al. 2015; Xia et al. 2015). CRD1이나 CRD2는 낮은 농도의 철 환경에서 나타나는 것으로 알려져 있다(Sohm et al. 2016). 이러한 clade들은 선호하는 환경 특성이 다르게 나타나며, 해양환경 변화에 따라 다양한 군집 조성을 보여준다.
남해 해역에 가장 큰 영향을 미치는 해류는 대마난류(김과 노 1991; Lie and Cho 1997)이며, 황해에서 유입되는 황해 저층 냉수 및 황해 연안수 그리고 겨울철에 생성되어 여름철 수온약층 아래에 분포하는 남해 연안수가 영향을 준다(Chang et al. 1995; 조와 김 1994; Kim et al. 1991). 그리고 하계에는 장강 저염수가 영향을 미치며 계절별로 복잡한 해양환경변화를 보인다(조 등 1995).
기후 변화로 인하여 해양 수온이 상승하고 있으며(IPCC 2014), 한반도 주변 해역의 수온도 증가하여(Kim et al. 2005), 아열대 해역화 될 것으로 예측되고 있다. 과거 26년간 남해 및 동중국해의 표층 수온이 매년 증가하고 있으며, 제주 해역에 위치해 있는 20.3°C 등온선은 최대 100 km 북상하였다(손 등 2012). 이에 따라 남해 해역에 대마난류가 미치는 영향이 커지고 있으며, 하계에는 중국의 강수량 증가로 남해에 미치는 장강 저염수의 영향 또한 커지고 있다(Gemmer et al. 2004; Qian and Lin 2005). 그러나 남해의 식물플랑크톤 연구는 그 중요성에 비해 매우 부족한 실정이다. 대부분의 연구가 연안과 가까운 해역에서 수행한 연구이며(박 등 2009; 백 등 2010; 장 등 2013; 이와 백 2017; 유 등 2018; Suh et al. 2015), 동중국해와 달리 남해에서 수행된 시아노박테리아에 대한 연구는 찾아보기 어렵다.
본 연구는 남해 해역에서 계절에 따라 다르게 나타나는 해양환경에서 시아노박테리아 군집 조성 및 개체수의 시공간적 변화 및 특성을 조사하였다. 특히, 계절별 대마난류의 영향을 받는 외해역과 연안역의 차이 그리고 하계의 장강 저염수에 의한 영향을 확인해 이후 해양환경 변화를 예측할 수 있는 기초 자료를 제공하는 데 중점을 두었다.
2. 재료 및 방법
조사 수역과 조사 시기
남해 해역에서 시아노박테리아 군집의 계절 변동 및 분포 특성을 파악하기 위해 2016년 8월(여름, 18~23일), 2016년 11월(가을, 29~30일), 2017년 2월(겨울, 8~14일) 그리고 2017년 5월(봄, 16~20일) 총 4회에 걸쳐 연구선인 온누리호를 이용하여 연구조사를 실시하였다. 남해 외나로도 남쪽 해역에서 시작하여 127.50°E 라인을 따라 남쪽 외해역 방향으로 정점 B0(34.3 N, 127.50 E), B3(34.08 N, 127.50 E), B6(33.83 N, 127.50 E), B8(33.67 N, 127.50 E), B10(33.51 N, 127.50 E) 그리고 F17(33.00 N, 127.50 E) 총 여섯 개의 정점에서 수행하였다(Fig. 1). 2016년 11월 추계 조사에는 F17 정점은 수행하지 못하였고, B11(33.25 N, 127.50 E) 정점으로 대체되었다.
물리 화학적 환경 자료
조사 해역의 물리 특성(수온, 염분)을 파악하기 위하여 Conductivity-Temperature-Depth (CTD, SBE 911 plus, Seabird scientific, USA)를 이용하여 각 정점의 수직 프로파일링 자료를 수집하였다. 해수 시료는 Rosette sampler에 부착된 10 L Niskin 채수기를 이용하여 채집 하였다. 표층, 10 m, 20 m, 30 m, 50 m, 75 m, 100 m 그리고 140 m 깊이를 표준 채수 수심으로 하고, 각 정점의 수심에 따라 조정하였다. 질산염과 인산염의 농도 분석을 위해 채수된 해수를 GF/F (25 mm, whatman) 여과지에 여과하여 polyethylene bottles에 넣어 보관하였고, 분석 시까지 -20°C 에서 보관하였다. 시료는 영양염 자동분석기(Smarchem 200, AMS alliance, Italy)를 사용하여 분석하였다.
총 엽록소 a 농도 및 시아노박테리아의 개체수
식물플랑크톤 총 엽록소 a농도 측정을 위하여 GF/F 여과지(25 mm, whatman)에 채집된 해수 500 ml를 여과하였으며, 분석까지 -70°C에서 보관하였다. 이후 95% 아세톤 6 ml를 사용하여 4°C의 암소에서 24 시간 추출하였다(Arar and Collins 1997). 이후 polytetrafluoethylene 필터로 여과하여 형광측정기(10AU; Turner Designs)를 이용하여 측정하였다. 시아노박테리아의 개체수 계수를 위하여, 채집된 해수를 40 μm 망으로 걸러준 뒤, 100 μl를 유세포분석기(Flowcytometer, Accuri C6, BD Biosciencese)를 이용하여 계수하였으며, Marie et al. (2000)의 방법을 따라 계수하였다. 그러나 표층 Prochlorococcus는 약한 엽록소 형광으로 인하여 계수가 어려워, Synechococcus의 개체수와 염기서열분석에서 얻어진 Synechococcus와 Prochlorococcus의 상대 비율을 이용하여 역으로 추산하였다. 하계에 장강 저염수의 영향을 받은 수괴의 총 엽록소 a 농도와 개체수 분포를 파악하기 위하여, 하계를 제외한 동계, 춘계 그리고 추계 기간의 관측된 염분 중 가장 낮은 염분인 32 이하의 수괴를 장강 저염수 영향을 받은 수괴로 분류하였다. 조사 해역의 평균 총 엽록소 a 농도와 개체수는 수심 50 m까지를 평균하여 분석하였다.
DNA Sequencing 분석 및 Clustering
DNA 분석을 위하여 수심별 시료 0.5~1 L를 polyesthersulfone 여과지(0.2 um supor® PES filter, Pall Corporation, NY, US)로 여과한 후 STE (100 mM NaCl, 10 mM Tris- HCL, 1 mM EDTA, pH 8.0) 완충액을 1 ml 넣어 분석까지 -70°C에 보관하였다. DNA 추출은 Phenol-Chloroform 추출법을 사용하였다(양 등 2021). Cyanobacterial 16S-23S rDNA Internal Transcribed Spacer (ITS) 증폭에 사용된 특이적 프라이머 염기서열은 ITS-af (5'-GGATCACCTCC TAACAGGGAG-3'), ITS–ar (5'-GGACCTCACCCTTAT CAGGG-3')를 이용하였다(Lavin et al. 2008). Miseq 분석을 위한 PCR은 Illumina 사에서 제공된 방법을 따랐다(Illumina 2013). 반응이 끝난 산물은 AMPure XP beads (Beckman Coulter, CA, Uniterd States)를 이용하여 정제 후, 산물을 Nanodrop-1000(Spectrophotometer, Thermo Scientific, USA)를 이용하여 정량하였다. 각 산물을 동일한 양이 들어가게 섞은 후 ChunLab (Seoul, Korea)에서 Illumina MiSeq 2 × 300 PE platform (Illumina, USA)를 이용하여 염기서열을 얻었다. 얻어진 염기서열은 Choi et al. (2013)의 방법을 이용하여 clade를 분류하였다. 획득한 각 clade에 해당하는 sequence의 reads 수를 상대 비율로 전환하였으며, 우점도 계산의 용이성을 위하여 출현한 OTU 중 한 시료에서라도 출현율이 1% 이상인 clade만 분석을 진행하였다. 조사 해역의 시아노박테리아 군집 조성 분포의 특성을 파악하기 위해 PRIMER 프로그램(PRIMER-E version 6)을 이용하여 계절별로 유사한 시아노박테리아 군집 조성을 가지는 시료끼리 Cluster를 분류하였다. Cluster 분석에 앞서 NGS 분석으로 얻어진 시아노박테리아 clade 상대 비율을 square root으로 변환한 후 Bray-Curtis 유사도를 이용하여 Cluster 분석을 실시하였다. 이후 유사도 75% 기준으로 각 계절의 Cluster를 분류하였다. 본 연구에 사용된 염기서열들은 SRA Database (SRA archive NCBI)에 등록하였다(accession no. PRJNA772557).
위성 자료 및 RDA 분석
남해에 월별 표층 수온과 엽록소 a 농도 분포를 확인하기 위해 위성 자료를 활용하였다. 조사 기간에 해당하는 2016년 8월과 11월, 2017년 2월과 5월의 평균 수온과 엽록소 a 농도는 NASA Ocean Biology Processing group의 4 km의 공간 해상도를 가지는 월별 합성 자료를 활용하였다(http;//oceancolor.gsfc.nasa.gov). 시아노박테리아 clade들과 환경 인자 간의 연관성을 살펴보기 위하여 중복 분석(Redundancy Analysis, RDA)을 프로그램 CANOCO 4.5를 이용하여 수행하였다. 사계절 조사 시료 중 하나의 시료에서라도 1% 이상 우점율을 보인 clade 22개의 상대 비율과 수온, 염분, 질산염, 인산염 그리고 광량을 환경 인자로 사용하였다. 염기서열의 상대 비율은 square root으로 변환하였으며, 환경 인자는 log(X+1)로 변환하여 분석하였다. 광량은 표층을 100으로 기준으로 하여 현장의 PAR 프로파일링 자료에서 유도된 Kd(PAR)값을 사용 하여 수심에 따른 광량을 얻었으며, 시료가 채집된 된 수심에 따라 광량을 적용하였다.
3. 결 과
조사 해역의 계절별 물리 · 화학 환경
연구 기간 동안 조사 해역의 수온은 7.4~30.6°C로 계절에 따라 큰 변이를 나타냈다(Fig. 2A). 계절별 수온은 동계부터 추계까지 각각, 7.4~17.2°C, 13.6~19.5°C, 12.5~30.9°C 그리고 14.2~21.4°C의 범위였으며, 모두 연안역 정점에서 외해역 정점으로 갈수록 수온이 증가하였다. 성층이 생성된 계절인 춘계, 하계, 추계에는 외해역에서 상층의 수온이 하층의 수온보다 높았다. 외해역 정점(B8~F17(B11))에서 표층과 수심 75 m의 수온 차이는 춘계, 하계, 추계 순으로 각각, 2.5~3.8°C, 14.7~18.7°C, 0.0~3.0°C로 하계에 가장 컸으며, 추계에 가장 작은 차이를 보였다.
조사 기간 중 염분은 28.8~34.7로 계절에 따라 크게 변동하였다(Fig. 2B). 계절별 염분 변동은 동계부터 추계까지, 33.2~34.7, 30.8~34.7, 28.8~34.6 그리고 32.3~34.7의 범위를 보였으며, 하계에 가장 낮은 염분이 관측되었다. 동계, 춘계, 추계에는 연안역에서 외해역으로 갈수록 염분이 높았으며, 하계에는 연안역 상층부 정점인 B6의 10 m에서 매우 낮은 28.8의 염분이 관측되었다. 하계 장강 저염수의 영향을 받은 연안역(Cluster A1)과 외해역(Cluster A4)의 상층부의 평균 염분은 각각, 30.7±1.5와 32.3±0.4로 외해역보다 연안역이 낮았다(Table 1).
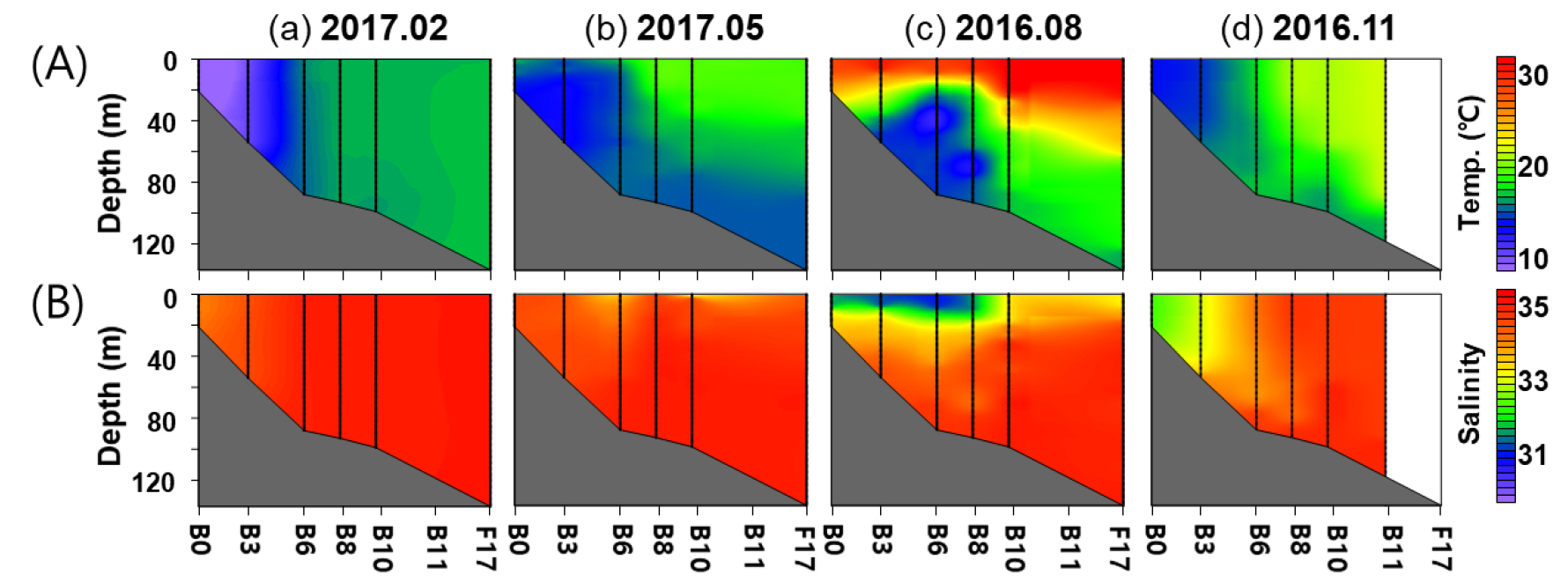
Fig. 2.
Contour plots showing the variation of (A) temperature and (B) salinity along the transect for each survey period. Vertical lines and gray shaded area represent depths with CTD data and sea bottom, respectively. From left to right: (a) February (winter) 2017, (b) May (spring) 2017, (c) August (summer) 2016, and (d) November (fall) 2016. Station F17 of November 2016 survey was not sampled
Table 1.
Values (Mean±SD) of environmental factors (Temperature, salinity, nitrate and Phosphate) for each group obtained from the cluster analyses (Fig. 4). Bold-letter clusters indicate those samples analyzed to be affected by the TWC
또한, 조사 결과 질산염과 인산염 농도의 범위는 각각, 0.01~12.14 μM와 0.00~0.90 μM으로 나타났으며, 계절 환경 변화에 따라 크게 변하였다. 수직 혼합이 활발한 동계에는 수심에 따른 질산염과 인산염 농도 변화가 크지 않았으며, 연안역 보다 외해역에서 낮았다(Fig. 3A, Table 1). 성층이 형성된 춘계와 하계에는 성층의 상층부의 질산염과 인산염 농도가 낮았으며, 수심이 깊을수록 농도가 높았다(Fig. 3A, Table 1). 하계에는 장강 저염수의 영향을 받은 수괴 (Cluster A1 & A4)에서도 매우 낮은 농도를 보였다(Table 1). 추계에는 외해역에서 성층의 영향으로 외해역 상층부에서 낮은 농도를 보였으며, 하층부에서 높은 농도를 보였다. 그러나 정점 B6의 질산염과 인산염 농도는 다른 정점과 비교하여 상대적으로 높은 영양염 농도를 보였다(Fig. 3A and B).
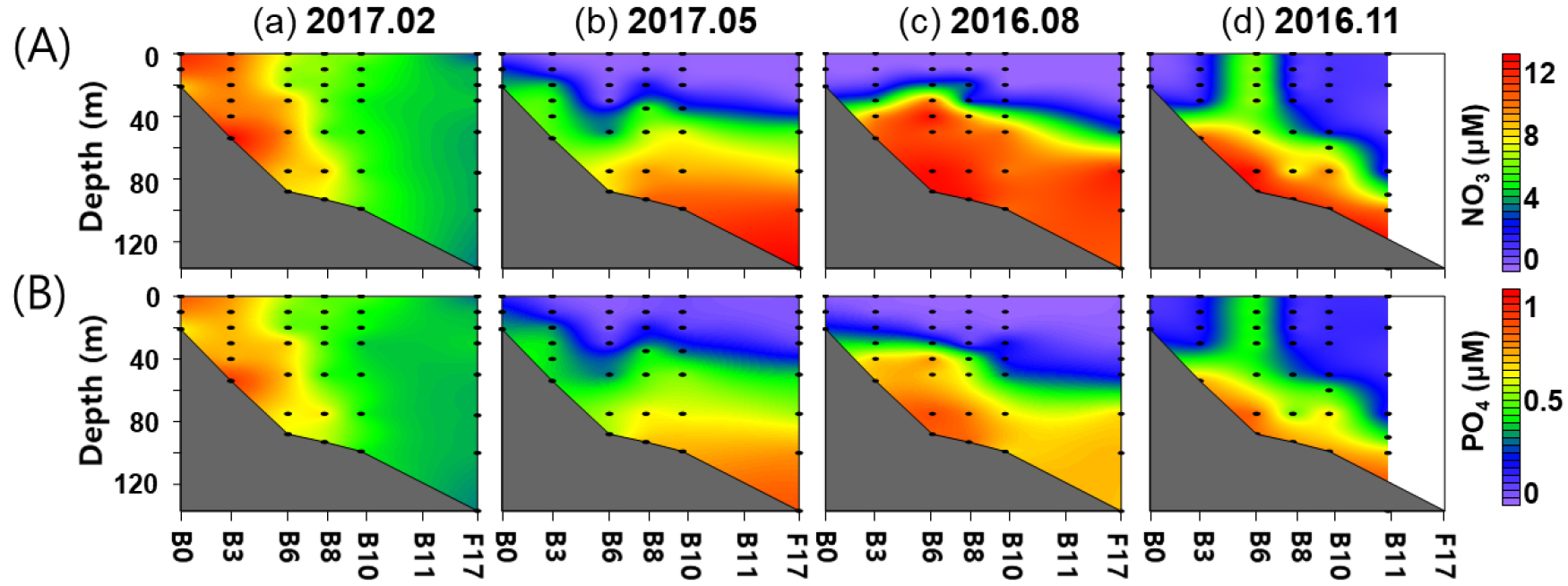
Fig. 3.
Contour plots showing the variation of (A) nitrate and (B) phosphate concentrations along the transect for each survey period. Black dots indicate sampling depths. From left to right: (a) February (winter) 2017, (b) May (spring) 2017, (c) August (summer) 2016, and (d) November (fall) 2016. Station F17 of November 2016 survey was not sampled
총 엽록소 a 농도와 시아노박테리아 개체수
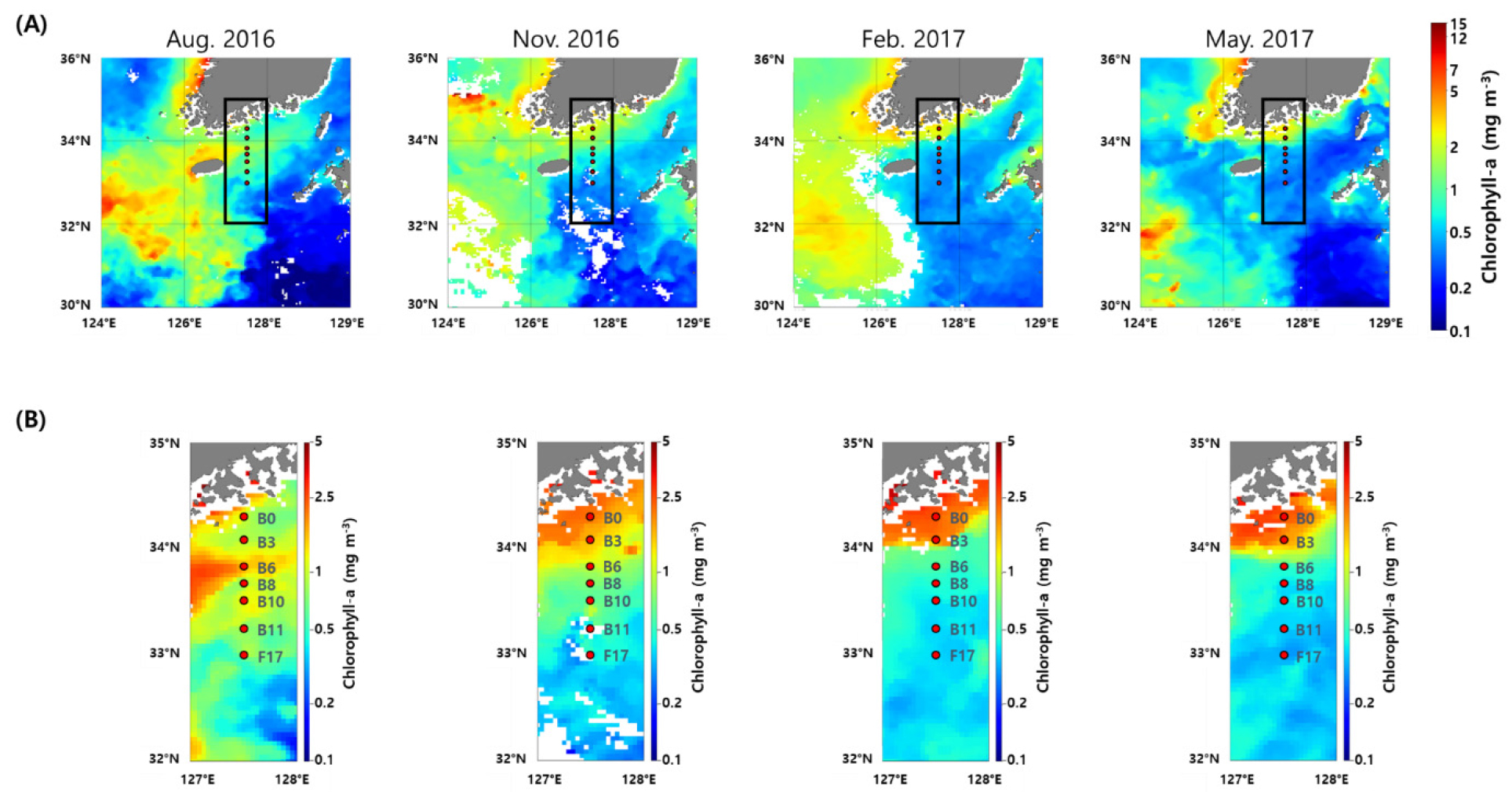
총 엽록소 a 농도는 사계절 모두 연안 해역에서 높게 나타났으며, 대마난류의 영향을 받는 외해역에서 낮았다 (Fig. 4A). 계절별 조사 해역의 수심 50 m까지의 평균 총 엽록소 a 농도는0.40±0.09~1.59±1.65 mg m-3의 변동을 보였다. 추계에 개체수가 가장 높았으며, 춘계, 하계 그리고 동계 순으로 높았다. 하계에 가장 높은 총 엽록소 a 농도는 장강 저염수의 영향을 받은 연안역 정점 B6의 10 m에서 1.70 mg m-3의 농도를 보였다. 장강 저염수의 영향을 받지 않은 수괴에 50 m 평균 총 엽록소 a 농도는 조사 해역 평균 0.34±0.19 mg m-3로 사계절 중 가장 낮았다.
Synechococcus의 개체수는 동계, 춘계, 추계에는 대마난류의 영향을 받는 해역에서 높았으나(Fig. 4B), 하계에는 장강 저염수의 영향을 받은 연안역 상층부에서 높은 개체수를 보였다(Fig. 4B). 계절별 조사 해역 수심 50 m까지의 평균 Synechococcus의 개체수는 3.3 × 103~2.2 × 105 cells ml-1의 분포를 보였다. 하계에 가장 높은 평균 개체수를 보였으며, 춘계, 추계 그리고 동계 순으로 높았다(Fig. 4B). 하계의 가장 높은 개체수는 장강 저염수의 영향을 받은 연안역 정점 B6의 10 m에서 9.8 × 105 cells ml-1로 나타났으며, 장강 저염수의 영향을 받지 않은 수괴의 Synechococcus 평균 개체수는 5.2±3.5 × 104 cells ml-1로 춘계의 평균 개체수보다는 낮았다.
Synechococcus의 개체수와 NGS분석을 이용한 Prochlorococcus 상대 비율로 추산한 Prochlorococcus 개체수의 변화를 보면(Fig. 4C), 춘계에는 거의 나타나지 않았다(Fig. 4C). 동계, 하계, 추계 조사의 50 m까지의 평균 Prochlorococcus 개체수는 미검출~7.5 × 103 cells ml-1의 분포를 보였으며, 하계, 추계, 동계 순으로 개체수가 높았다(Fig. 4C). Prochlorococcus의 개체수는 외해역에서 높았으며, 연안역에서는 매우 낮은 개체수를 보였다.
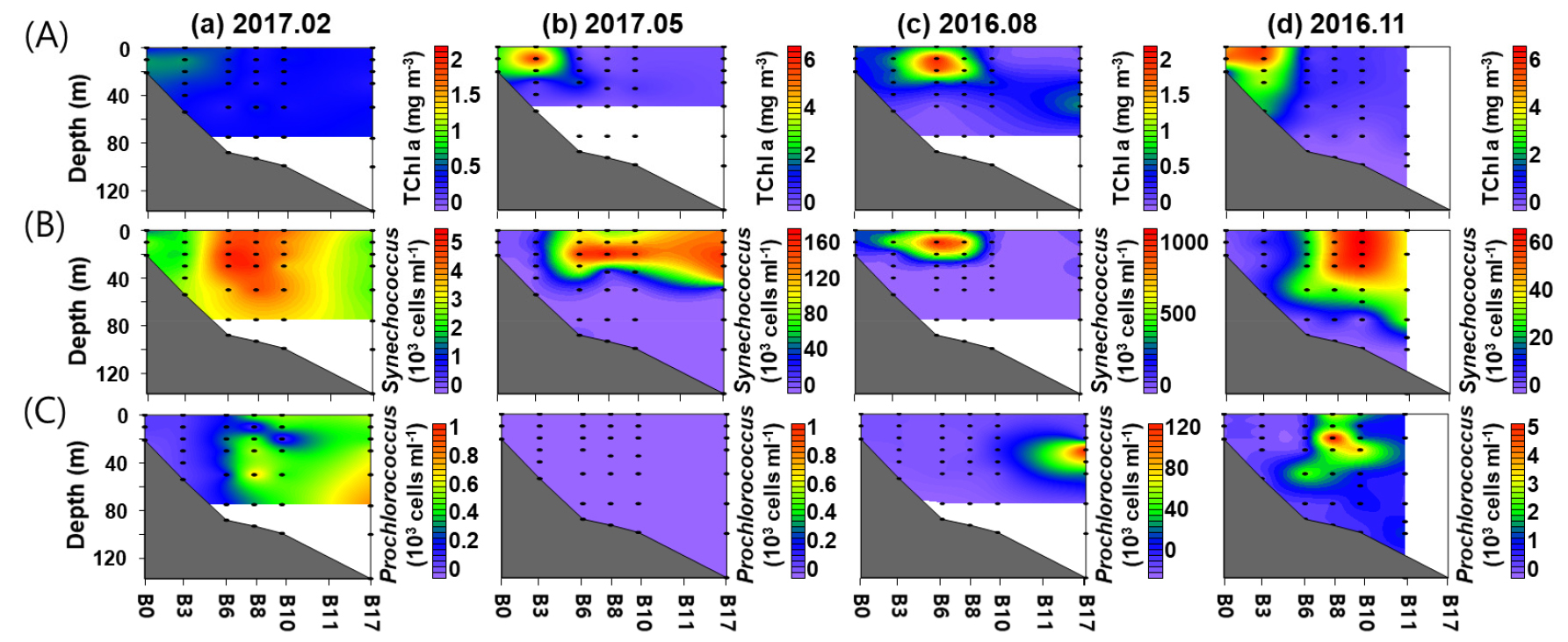
Fig. 4.
Contour plots showing the variation of (A) total chlorophyll a concentration, (B) Synechococcus and (C) Prochlorococcus abundance along the transect for each survey period. Black dots indicate sampling depths. From left to right: (a) February (winter) 2017, (b) May (spring) 2017, (c) August (summer) 2016, and (d) November (fall) 2016. Station F17 of November 2016 survey was not sampled. Note that the scales are different for each survey period to accommodate the spatial difference
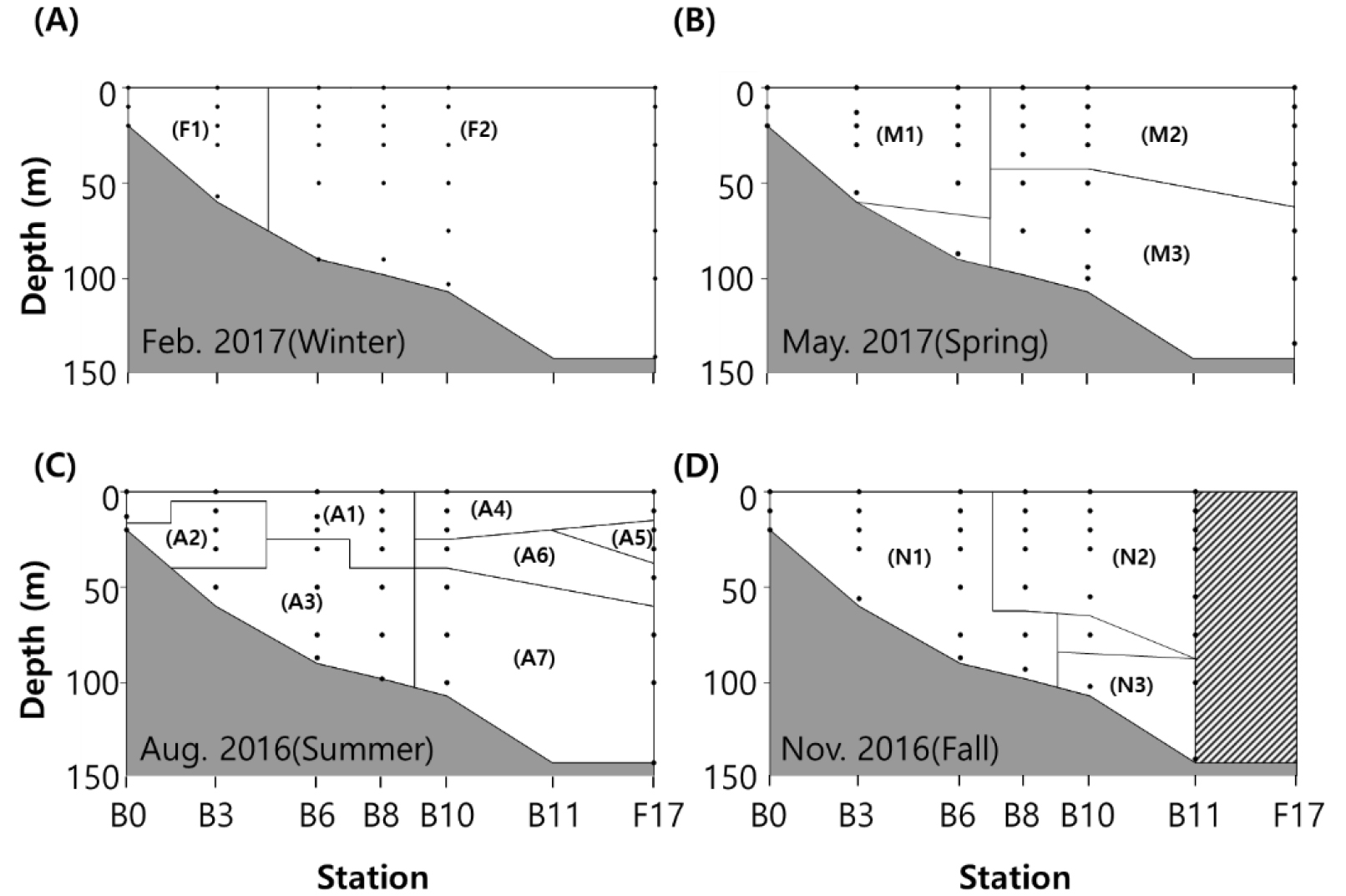
계절별 Cluster의 환경 특성
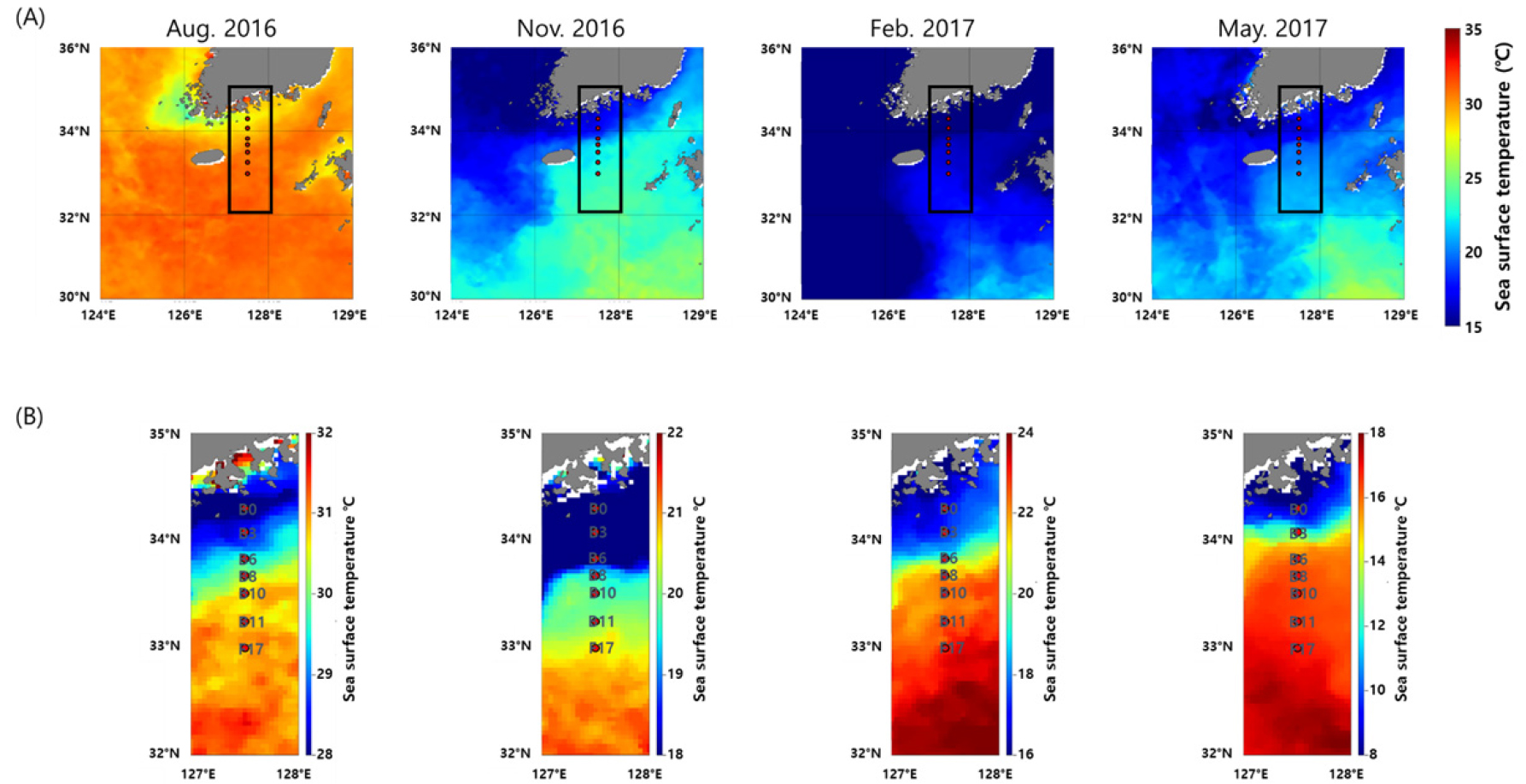
조사한 시기의 위성을 활용한 표층 수온 분포를 보면(Fig. 5), 모든 계절에서 수온에 의한 전선이 형성되었다. 형성된 전선의 영향으로 시아노박테리아의 다양성은 사계절 모두 연안역 Cluster와 대마난류의 영향을 받는 외해역 Cluster로 나뉘었다(Figs. 6 and 7). 동계, 춘계, 추계의 연안역 Cluster인 F1, M1, N1은 낮은 수온과 높은 영양염 환경을 보였다(Fig. 8A, Table 1). 동계의 외해역 Cluster인 F2는 F1보다 높은 수온과 낮은 영양염 환경을 보였다. 춘계와 추계는 외해역의 성층의 형성으로 상층부와 하층부로 두 개의 Cluster로 나누어졌으며(Figs. 6B and D, 7B and D), 두 계절 모두 상층부 Cluster인 M2와 N2는 높은 수온과 낮은 영양염 농도를 보였다(Fig. 8C and D, Table 1). 반면, 하층부 Cluster인 M3와 N3는 상대적으로 낮은 수온과 높은 영양염 농도를 보였다. 하계의 Cluster는 총 7개로 분류되었으며, 장강 저염수 영향을 받는 연안역 Cluster인 A1과 외해역 Cluster인 A4는 각각 다른 연안역 Cluster (A2–A3)와 외해역 Cluster (A5–A7)와 비교해 낮은 염분과 높은 수온을 보였고 영양염 농도는 낮았다(Table 1). 연안역 Cluster인 A2와 A3는 A1과 비교하여 수온은 낮았고 영양염 농도는 상대적으로 높았다(Fig. 8C, Table 1). 외해역 Cluster인 A5–A7도 A4와 비교하여 낮은 수온과 높은 염분을 보였으며, 영양염 농도는 높았다.
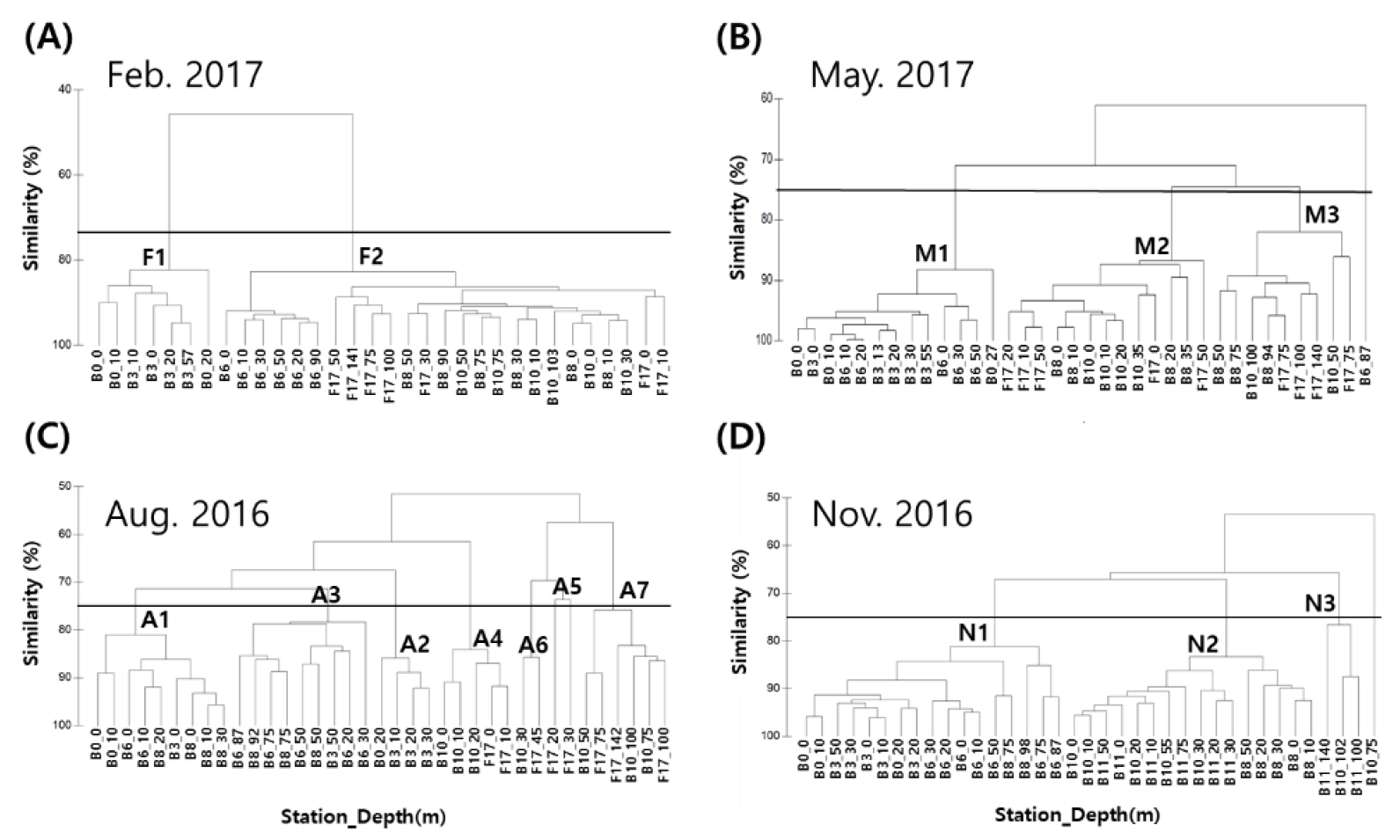
Fig. 6.
The dendrogram from the cluster analysis based on the community structure of cyanobacteria clades for each depth layer separately for (A) February (winter) 2017, (B) May (spring) 2017, (C) August (summer) 2016, and (D) November (fall) 2016. Bold letters in the dendrogram indicate divided clusters. The thick black lines indicate a similarity of 75%
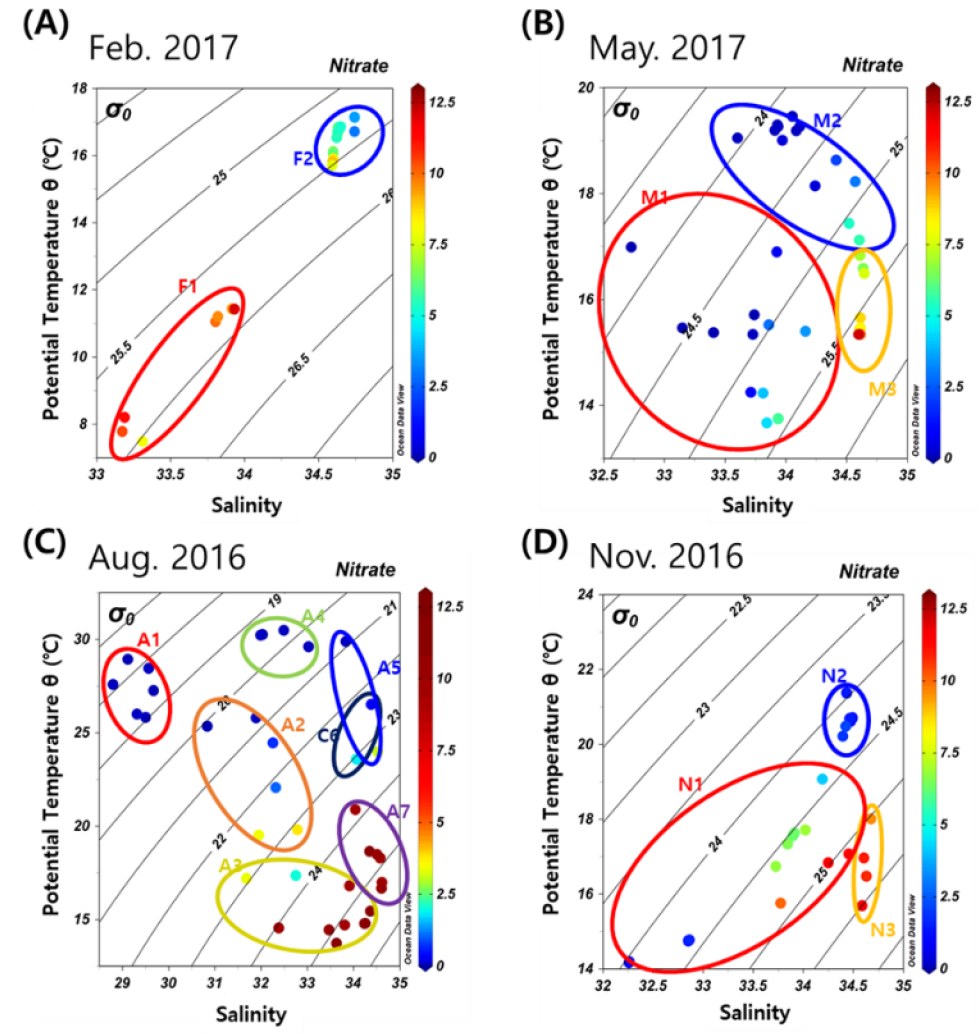
Fig. 8.
T-S diagram of sampling depths for cyanobacterial parameters in each seasonal surveys: (A) February (winter) 2017, (B) May (spring) 2017, (C) August (summer) 2016, and (D) November (fall) 2016. Color circles indicate groups of the same cluster obtained in the cluster analyses in Fig. 4. In November 2016 and May 2017, non-clustered samples were excluded. The color of each symbol and color bar represent the nitrate concentration (μM)
계절별 시아노박테리아의 다양성
Prochlorococcus는 사계절 모두 대마난류의 영향을 받는 외해역에서 Cluster가 우점율이 높았다(Table 2). 하계, 추계, 동계 순으로 높았고, 춘계에 0.1±0.3%로 가장 낮았다. 하지만 하계에 장강 저염수의 영향을 받은 외해역 Cluster A4에서의 우점율은 A5–A6와 비교해 낮았다(Table 2). HL ecotype (높은 광량을 선호하는 생태형)의 clade는 HLII/VI가 가장 우점하였으며, LL ecotype (낮은 광량에 적응한 생태형)은 clade LLI의 우점율이 높게 나타나면서, 이 두 clade가 주로 우점하였다. HL ecotype은 상대적으로 상층의 Cluster에서 우점율이 높았고, LL ecotype은 저층 Cluster에서 높은 경향을 보였다(Table 2).
Table 2.
Relative percentages of cyanobacterial clades (Mean±SD) for each group obtained from the cluster analyses (Fig. 4). Bold-letter clusters indicate those samples analyzed to be affected by the TWC. Only clades that have dominance of more than 1% at least one sample are shown. ND, ≤ 0.1%
Synechococcus clade I과 IV는 사계절 모두 외해역 Cluster보다 연안역 Cluster에서 높은 우점율을 보였으며, 외해역에서는 성층의 상층부보다 하층부 Cluster에서 우점율이 높게 나타났다(Table 2). Clade IV는 I과 비슷한 경향을 보였으나, 춘계에 외해역 성층의 상층부 Cluster (M2)에서 평균 49.0±3.6%의 높은 우점율을 보였으며, clade I보다 높은 우점율을 보였다. 또한, clade II는 연안보다 외해역에서 높은 우점율을 보였으며, 수온이 높은 하계와 추계에는 연안역 Cluster에서도 가장 우점하였다. 장강 저염수의 영향을 받은 Cluster A1에서는 하부 Cluster (A2–A3)와 비교해 우점율이 감소하였고, 장강 저염수의 영향을 받은 외해역 Cluster A4에서는 외해역의 다른 Cluster (A5–A7) 보다 높은 우점율을 보였다. Clade III은 다른 계절과 비교하여 하계에 상대적으로 우점율이 높았으며, 장강 저염수 영향을 받은 Cluster (A1, A4)에서 상대적으로 높은 우점율을 보였다. Clade V, VI, WPC1 그리고 5.3-MS3는 하계에 연안역에서 상대적으로 우점율이 높았고, 장강 저염수의 영향을 받은 Cluster (A1, A4)에서도 높은 우점율을 보였다. Clade CB1, CB5는 연안역 Cluster에서 상대적으로 높은 우점율을 보였으며, 다른 계절과 비교해 하계에 높은 우점을 보였다(Table 2). 하계 장강 저염수의 영향을 받은 Cluster (A1, A4)보다 대마 난류의 영향을 받은 중층의 Cluster (A2, A5)에서 우점율이 높았다. 그리고 clade 5.3-I/II는 하계와 추계에 상대적으로 높은 우점을 보였으며, 저층에서 높은 우점을 보였다(Table 2). Clade XVI 그리고 XVII는 하계와 추계에 외해역 저층이서 우점율이 높았으나, XVI는 하계를 제외하고 거의 출현하지 않았다(Table 2). Clade VII과 IX는 하계와 추계에 우점율이 높았으며, 성층 상층부에서 높은 우점율을 보이는 것으로 나타났다. Clade CB1과 CB5도 하계 연안역에서 높은 우점율을 보이는 것으로 나타났다.
시아노박테리아 clade와 환경 인자의 RDA 분석
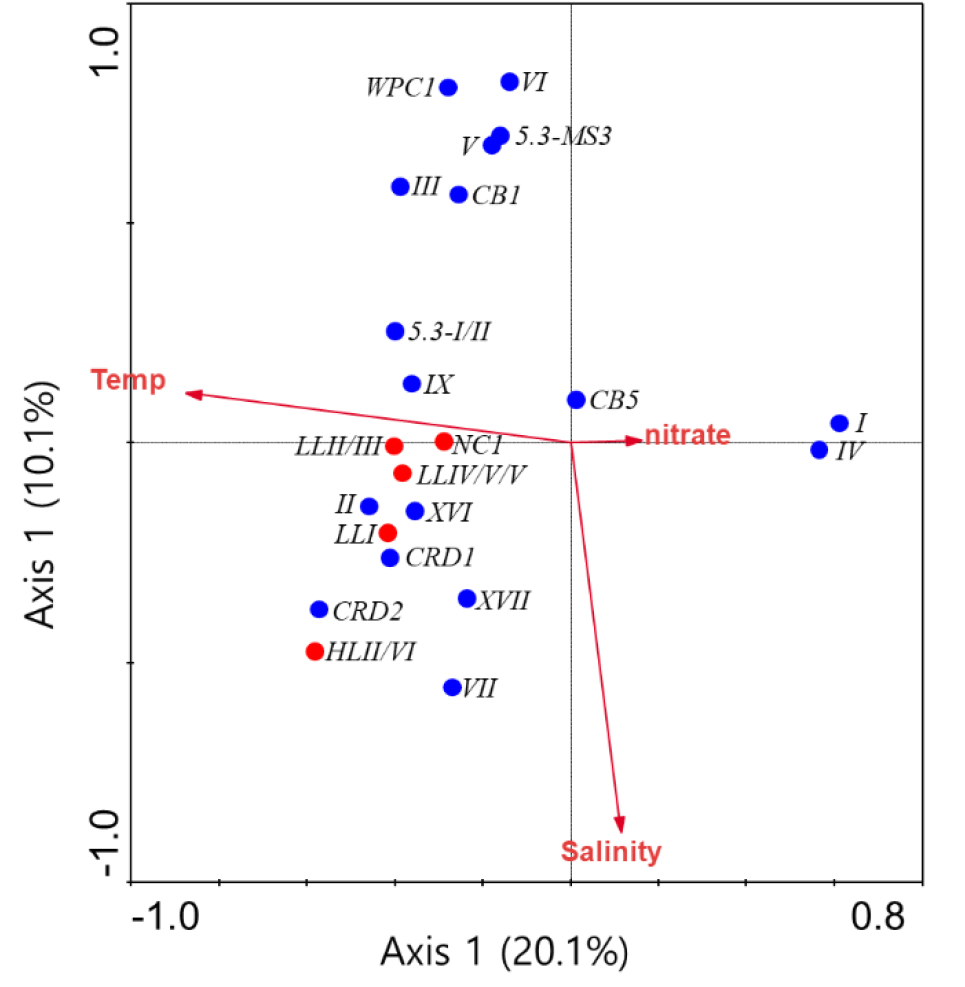
RDA 분석 결과, 시아노박테리아 clade의 분포는 수온, 염분 그리고 질산염의 영향을 받는 것으로 나타났다(Fig. 10). Clade I과 IV는 수온과 음의 상관관계를 질산염과 양의 상관관계를 보였다. Clade CB5는 수온 및 질산염과는 상관관계가 없었으나, 염분과는 약한 상관관계를 보였다. 그 외 clade은 모두 수온과 양의 상관관계를 질산염과 음의 상관관계를 보였다. Clade III, V, VI, WPC1, CB1 그리고 5.3-MS3는 염분과 음의 상관관계를 보였으며, 5.3-I/II와 IX는 염분과 약하게 음의 상관관계를 보였다. 그 외 clade들은 염분과 양의 상관관계를 보였다. Prochlorococcus clade들은 수온과 양의 상관관계를 보였으며, 질산염과 음의 상관관계를 보였다(Fig. 10).
4. 토 의
계절별 환경변화에 따른 Synechococcus개체수 분포
조사 해역의 Synechococcus의 평균 개체수는 수온에 따라 변동을 보였다. 평균 수온이 가장 높았던 하계에 가장 높은 평균 개체수를 보였으며, 평균 수온이 가장 낮은 동계에 평균 개체수가 가장 낮았다(Figs. 2A and 4B). 동중국해의 Synechococcus의 개체수는 하계인 8월에 높은 생장률을 보이는 것으로 보고 되었는데(Chang et al. 2003; 박 등 2019), 남해 해역에서도 유사한 계절 변화 양상을 보였다. Synechococcus의 생장률은 수온과 양의 상관관계를 가지며(Agawin et al. 1998), 온대해역에서는 수온이 5°C 이상 되어야 개체수가 증가하기 시작한다(Waterbury et al. 1986). 또한, 남해와 가까운 동중국해에서 수행한 Synechococcus 개체수에 대한 연구에서 표층 수온이 19~20°C 이하에서는 Synechococcus가 동계의 낮은 개체수 수준에 머물러 있다는 결과를 보였다(Chang et al. 1996; Chiang et al. 2002). 본 연구에서도 동계, 춘계 그리고 추계 조사에서 대마난류의 영향을 받은 외해역에서만 20°C 이상의 수온이 관측되었으며(Fig. 2A), 높은 수온을 가진 대마난류의 영향을 받는 외해역에서 Synechococcus의 개체수가 높았다. 하계에 Synechococcus총 엽록소 a 농도가 높게 나타난 연안역 상층부(수심 20 m 이내)에서 높은 개체수를 보이며(Fig. 4A and B), 다른 계절과 다르게 연안역에서 더 높은 개체수를 보였다(Fig. 4B). 하계에 장강 저염수의 영향을 받지 않은 수괴의 평균 개체수는 5.2±3.5 × 104 cells ml-1로 춘계보다 낮았다. 그러나 하계에 장강 저염수의 영향을 받지 않은 수괴의 Synechococcus 평균 개체수가 춘계와 비교하여 낮게 나타난 것은 개체수가 높게 나타난 정점들이 장강 저염수의 영향을 받은 수괴로 분류되면서 저평가 된 것으로 생각된다. Synechococcus는 온대해역에서 하계에 가장 높은 개체수를 보이는 것으로 나타났으며, 이전 연구에서도 제주 남해, 지중해 그리고 Chesapeake만 등 온대 해역에서 수행된 조사에서 Synechococcus의 개체수는 하계에 가장 높았다(박 등 2019; Agawin et al. 1998; Wang et al. 2011). 하계에 대마난류의 영향을 받은 외해역 보다 연안역에서 더 높게 나타난 Synechococcus의 개체수는 장강 저염수를 통해 유입된 결과로 보인다. 8월에 남해 표층 엽록소 a 농도 분포를 보면(Fig. 9A), 동중국해부터 연구 해역까지 높은 농도의 엽록소 a가 나타나고, Moon et al. (2019)의 연구에서도 조사 시기인 2016년 8월에 장강 저염수가 제주 해협을 통해 유입되었다. Timmermans et al. (2005)의 연구에서 Synechococcus의 반포화상수는 인산염에 비하여 질산염이 높아 질산염에 대한 요구량이 높은 것으로 추정할 수 있고, 장강 저염수를 통하여 높은 농도의 질소원이 동중국해로 공급된다(Tong et al. 2017). 또한, 하계에 장강 하구에서 시아노박테리아의 개체수가 높게 나타나는 연구를 보아(Chung et al. 2015) 하계 동중국해로 유입된 장강 저염수의 영향으로 높아진 Synechococcus가 제주해협을 따라 남해 연안역으로 유입되어 높은 Synechococcus 개체수가 나타난 것으로 생각된다. 춘계와 추계 기간 대마난류의 영향을 받는 외해역에서 성층 상부 수온은 20°C 이상 이였으며, 동계와 비교 하여 높은 Synechococcus 개체수를 보였다. 특히, 춘계에 수심 50 m 까지 평균 개체수는 7.5±5.8 × 104 cell ml-1 로 동계와 비교하여 약 200배 이상의 개체수를 보여 이전 연구와 유사하게 사계절 모두 Synechococcus 개체수 변동에 수온이 가장 중요한 요인으로 나타났다(Chang et al. 2003; 박 등 2019).
대마난류를 통한 Prochlorococcus의 유입
남해의 Prochlorococcus는 높은 수온과 낮은 영양염류를 가지는 대마난류 환경 하에서 높게 우점하였다(Table 2). Partensky et al. (1999)의 연구에서 Prochlorococcus는 낮은 수온에서 성장이 제한되어 15°C 아래 수온에서는 나타나지 않으며, Prochlorococcus는 빈 영양 열대 해역에서 높은 개체수를 보였다(Choi et al. 2011; Partensky et al. 1999; Partensky and Garczarek 2010; Scanlan et al. 2009). 동계, 춘계 그리고 추계의 연안역 수온은 15°C 내외로 Prochlorocoocus가 출현하기 어려운 환경이었으며(Fig. 2A), 조사 해역의 위성으로 확인한 사계절 수온 분포로 알 수 있듯이(Fig. 5), 사계절 모두 남해에 형성된 수온 전선으로 인하여 Prochlorococcus는 연안 해역으로 유입되지 못하고, 대마난류에 영향을 받은 외해역에서만 나타난 것으로 보인다. 하계 남해역으로 유입되는 장강 저염수에는 Prochlorococcus의 개채수 및 우점율이 낮게 낮았다(Cluster A1 and A4). 이전 동중국해에서 장강 저염수의 영향을 받은 수괴에서는 Prochlorococcus가 나타나지 않았으며(최 2012; 박 등 2019), 본 연구에서도 장강 저염수의 영향을 강하게 받은 연안역 상층부(Clsuter A1)에서는 아주 낮은 개체수를 보였고(Fig. 4C), 영향을 약하게 받은 외해역 상층부(Cluster A4)에서도 Prochlorococcus 우점율 및 개체수는 외해역 하층부(Cluster A5)와 비교하여 낮았다(Fig. 2C, Table 2). 남해에 나타난 Prochlorococcus clade는 상층에선 높은 광을 선호하는 HLII/VI가 가장 우점하였으며, 수심이 깊어질수록 낮은 광에 적응한 LLI 및 LLIV/V/VI의 우점율이 증가하면서 광량의 수직 분포가 중요한 영향을 미치는 것으로 나타났다(Table 2).
계절별 해양환경에 따른 Synechococcus 다양성
Clade I과 IV는 같이 우점하는 것으로 알려져 있으며(Sohm et al. 2016), 낮은 수온과 높은 영양염 환경을 선호한다(Zwirglmaier et al. 2007, 2008). 본 조사에도 비슷한 결과를 보이며 연안역에서 높은 우점율을 보였다. Tai and Palenik (2009)의 연구에서 clade IV가 clade I과 비교해 연중 광범위하게 나타나며, clade IV가 선호하는 해양환경의 범위가 넓다는 것을 보여준다. 본 연구에서도 clade IV가 춘계 기간 대마난류 영향권의 상층부에서 평균49%로 높은 우점율을 보이며, clade I과 다른 생태적 특성을 가지는 것을 보였다(Table 2). Clade II, VII, IX, CRD1 그리고 CRD2는 대마난류의 영향이 강한 해역에서 높은 우점율을 보였다. Clade II는 높은 수온의 빈영양 열대 아열대 해역에서 높게 나타나며 (Zwirglmaier et al. 2007, 2008), CRD1 and CRD2는 저위도의 철분 농도가 낮은 해양환경에서 높은 우점을 보인다(Sohm et al. 2016). VII는 열대 및 아열대 해역에서 광범위하게 나타나며(Hunter- Cevera et al. 2016), 본 연구에서 clade II, VII, CRD1, CRD2가 대마난류의 영향이 강한 해역에서 우점율이 높게 나타나는 특성과 같은 결과를 보였다. clade IX는 쿠로시오 해류에서 높은 우점율을 보여주는 연구가 있으며(Choi et al. 2015), clade IX의 배양주 중 광염성의 특성을 가지는 배양주가 존재하나(Xia et al. 2015), 본 연구해역에서는 광염성의 특성은 보이지는 않았다. Clade III은 clade II와 비슷한 환경인 고온의 빈영양 환경을 선호하며, 같이 나타나는 분류군으로 알려져 있다(Sohm et al. 2016; Zwirglmaier et al. 2007, 2008). 그러나 본 연구에서는 clade III가 장강 저염수의 영향을 받은 수괴에서 우점율이 증가하였다. 이전 동중국해 연구에서 clade III는 저염수 유입 환경에서 잘 성장할 수 있음을 보였다(최 2012). 동중국해와 남해 하계에 나타나는 clade III는 이전에 알려진 clade III와 생리적 특성이 다를 가능성을 보여주며, 추후 배양주 수준에서 자세한 연구가 필요해 보인다.
Clade V는 연안에 높은 영양염 조건을 선호하며(Post et al. 2011), VI은 동중국해의 저염수 패치에서 높은 비율을 보이는 것으로 보고되어 있다(최 2012). 본 연구에서도 clade V가 연안역에서 높은 우점을 보였으며, 장강 저염수 영향을 받은 Cluster (A1 & A4)에서 우점율이 증가하였다(Table 2). 상기 clade들은 높은 영양염 조건을 선호하며, 광염성 특성을 보이는 것으로 판단된다(Fig. 10). WPC1 또한 저염수 환경에서도 잘 성장한다는 연구 결과가 있으며(최 2012), 본 연구도 같은 경향을 보였다. WPC1은 저위도에서는 나타나지 않으며(Choi et al. 2011), 현 연구에서도 연안역 저층에서 높은 우점율을 보이는 것으로 보아 높은 영양염 조건을 선호하는 것으로 나타났으나, 8월 동해 하계에 빈영양 난수 환경에 높은 비율을 보이는 상반된 결과도 존재한다(Choi et al. 2015). 이는 WPC1이 광범위한 환경에서 적응이 가능한 분류군으로 WPC1 clade 내에 배양주 또는 종간 생태적 특성이 다르게 나타나는지 추가적인 연구가 필요하다. Clade 5.3-MS3에 대한 생태적 연구는 많이 부족하나 본 연구에서는 장강 저염수의 영향 하에서 우점율이 증가하였고, 하계와 추계 기간 연안역에서 우점율이 높았다. RDA 분석에서도 염분과 음의 상관을 보여 낮은 염분에도 적응하는 분류군으로 보인다. Babić et al. (2017) 연구에서도 5.3-MS3는 비교적 연안에 가까운 정점에서 우점하였다. 위 clade들은 낮은 염분의 조건에서도 성장이 가능한 광염성의 clade로 보이며, 하계 장강 저염수의 영향에 따라 우점 비율이 달라질 것으로 예상된다.
Clade XVI, XVII, CB1, CB5 그리고 5.3-I/II는 수온이 따뜻한 하계에 영양염이 풍부한 저층에서 우점율이 높았다(Tables 1 and 2). Xia et al. (2015)의 연구에서 clade XVI는 수온과 음의 상관관계를 보였으며 저층에서 높은 우점을 보였다. 그러나, 현 조사의 RDA 분석에서는 수온과 양의 상관관계를 보여 상반된 결과를 보였다(Fig. 10). Xia의 연구는 평균 수온이 높은 저위도에서 수행되었으며, 본 연구는 상대적으로 평균 수온이 낮은 중위도에서 수행된 차이가 존재한다. 평균 수온이 높은 저위도에서는 수온과 음의 상관 관계를 보이고 평균 수온이 상대적으로 낮은 현 조사 해역인 중위도에서는 양의 관계를 보이는 것으로 보아 따뜻한 수온을 선호하는 것으로 생각된다. 게다가 두 연구 결과 모두 저층에서 나타나는 공통점을 보이며 높은 영양염 조건을 선호하는 것으로 보인다. Clade XVII은 표층의 연 평균 수온이 28°C 이상인 Warm Pool의 저층에서 높은 우점율을 보이며(Choi et al. 2015), 높은 수온과 높은 영양염 조건을 선호하는 것을 시사하였다. 본 연구의RDA 분석에서는 clade XVII이 영양염 농도와 음의 상관관계를 보여 이전 연구와 다른 경향을 보였으나(Fig. 10), XVII가 높은 수온을 선호하는 특성을 가지고 있어 상대적으로 낮은 영양염 농도에서 높은 우점율이 나타나면서 RDA 분석에서는 영양염 농도와 음의 상관관계가 나타난 것으로 판단된다. 실제 clade XVII의 상대 비율 분포를 보면(Table 2), 높은 영양염 환경의 Cluster에서 상대적으로 높은 우점율을 보였다(Table 1). Clade 5.3-I/II는 Huang et al. (2012)의 연구에서 고위도의 표층에서만 출현하였으며, Choi and Noh (2009)의 연구에서도 동해의 10월과 11월 표층에서만 나타났다. 그러나 본 연구에서는 하계에 연안 및 저층에서 우점율이 높았다(Table 2). 본 연구에 사용된 16s–23s ITS 염기서열 분석을 통해 5.3-I과 5.3-II를 구별하기 어렵다. 5.3-II는 저위도 저층에서 높게 나타나며(Huang et al. 2012), 본 연구에서 하계의 저층에서 높게 나타나는 생리적 특성으로 보아 clade 5.3-I보다는 clade 5.3-II일 것으로 보인다.
Clade CB1과 CB5는 하계 강 하구에서 나타나는 clade로 알려져 있다(Chen et al. 2006; Huang et al. 2012). 본 조사에서도 CB1은 하계에만 나타났으며, 대마난류의 영향을 받은 Cluster에서는 나타나지 않았다(Table 2). RDA 분석에서도 염도와 음의 상관관계를 보여 상대적으로 염도가 낮은 연안에서 나타나는 이전 연구와 비슷한 결과를 보여, clade CB1과 CB5는 따뜻한 수역의 낮은 염분과 영양염이 높은 환경을 선호하는 것으로 생각된다. 그러나CB1과 CB5가 선호하는 환경을 가지는 장강 저염수의 수괴(Cluster1 & 4)에서는 오히려 우점율이 감소 하였다(Table 2). 이는 CB1과 CB5는 장강 저염수를 통해 남해로 유입되기 보다 남해 연안에서 유입되는 강수의 영향을 받은 것으로 여겨진다.
5. 결 론
사계절 조사를 통해 남해 연안의 시아노박테리아 개체수가 계절에 따라 크게 변화하며 이러한 변화에 수온이 큰 영향을 미치는 것으로 파악되었다. 또한 계절에 따라 다양한 clade의 시아노박테리아가 출현하여 군집 조성의 계절 변동 양상도 컸다. 이러한 시아노박테리아의 계절 변동은 대마난류, 장강 저염수의 유입이 중요한 영향을 미치는 것으로 나타났으며, 이러한 결과는 향후 기후변화에 따른 대마난류와 장강 저염수의 세력 변화에 따라 남해에서 시아노박테리아의 개체수 및 다양성 분포 뿐만 아니라 이들의 생태적 기능의 변화가 나타날 수 있음을 시사한다. 본 연구는 단기간 수행된 계절 연구로 계절 간의 특성은 살펴볼 수는 있었으나, 쿠로시오 분지류 및 장강 저염수의 유입 규모의 변동 등에 따른 남해역 시아노박테리아의 생태적 분포와 기능에 대한 직접적인 영향을 이해하기 위해서는 광역적이며 장기적인 조사가 필요할 것으로 보인다.