1. 서 론
2. 재료 및 방법
환경요인 분석
식물플랑크톤 분석
3. 결 과
수온, 염분, 용존산소, 영양염의 변화
식물플랑크톤 현존량 및 엽록소-a 변화
식물플랑크톤 종조성 및 변화
주요 유해 식물플랑크톤 출현 양상
4. 고 찰
5. 적 요
1. 서 론
남해에 위치한 진해만은 해안선 굴곡이 심하며, 거제도와 가덕도에 둘러싸인 반폐쇄성 내만이다. 지형적으로 두 개의 좁은 수로(가덕수로, 견내량수로)를 통해 외측 연안과 연결되어 있어 해수 교환이 원활하지 않은 해역이다. 하지만 기상 조건에 따라서 해황의 변동이 심하며, 외양과 내만의 혼합 정도가 커서 난류 형성이 보고되기도 한다(Han et al. 1991). 수문학적으로 진해만은 외해수와 담수 등 여러 수괴가 접하는 지역으로 매우 복잡한 구조를 가지고 있다. 진해만에 포함되어 있는 마산만과 행암만, 원문만 및 고현만은 해수의 유동이 원활하지 못한 온대 내만 해역으로서 일반적으로 여름철에 육지로부터 담수가 유입되고 표층수의 수온 상승으로 저층으로의 산소 공급이 원활하지 못해 저산소 수괴를 형성한다(Lee 1993).
진해만은 지난 수십 년간 어패류의 산란과 성육장 역할을 해왔으며, 패류양식이 성행하여 국내 굴 생산량의 63%를 차지하고 있다(2012년 기준, Jin et al. 2019). 해산물의 수요가 증가하면서 이에 높은 비중을 차지하는 패류의 양식 규모도 증가하는 추세이지만, 부영양화로 인한 적조, 빈산소수괴 발생 등의 환경문제가 연안생태계 및 양식장에 부정적 영향을 미친다(Kim and Kim 2003; Kim et al. 2012; Lee et al. 2017, 2018, 2020). 특히, 봄철에 독성 플랑크톤이 과다 증식하면, 이매패류는 세포를 여과 섭식하여 체내에 독소를 축적한다. 패류독소는 국민의 식품위생 및 건강과 직결되어 있기 때문에 어패류 식중독 방지를 위해 패류독소 및 독성 플랑크톤 모니터링이 꾸준하게 진행되고 있다.
진해만 해역을 중심으로 다양한 식물플랑크톤 연구가 수행되었으며, 플랑크톤의 분류(Yoo and Lee 1979), 분포와 군집구조(Park et al. 2001; Yoo et al. 2007; Baek and Kim 2010), 적조생물의 분포 특성 및 발생 기작(Park 1982; Lee et al. 2005)이 주요하게 파악되었다. 특히 적조 발생과 관련하여 환경인자와 식물플랑크톤의 성장특성(Yoo and Lee 1979, 1980), 적조원인생물 분포 및 발생 기작(Cho 1978, 1979; Lee et al. 1981, 2005; Park 1982), 부영양화 제어 수치 모델과 식물플랑크톤 군집 구조 수치모델(Kim et al. 1995), 광환경에 따른 광합성 특성(Park et al. 2001) 등의 개별적인 연구들이 수행되었다. 지금까지 보고된 진해만 대상의 연구는 단기간의 식물플랑크톤 분포 및 군집 구조에 관한 것이다.
최근의 해양환경 변화는 식물플랑크톤 군집 및 조성의 변화를 야기하고 있다. 1980년대 이후, 진해만 해역의 식물플랑크톤은 군집의 천이가 다수 보고되었으며, 이에 따라 장기적 정기 모니터링 자료 구축이 필요하다. 따라서, 본 연구는 2017년부터 2022년까지 6년간 진해-마산만의 물리화학적 요인과 식물플랑크톤을 모니터링하여, 공간적, 환경적 요인에 따른 식물플랑크톤 군집구조의 변화를 조사하여 보고하였다.
2. 재료 및 방법
환경요인 분석
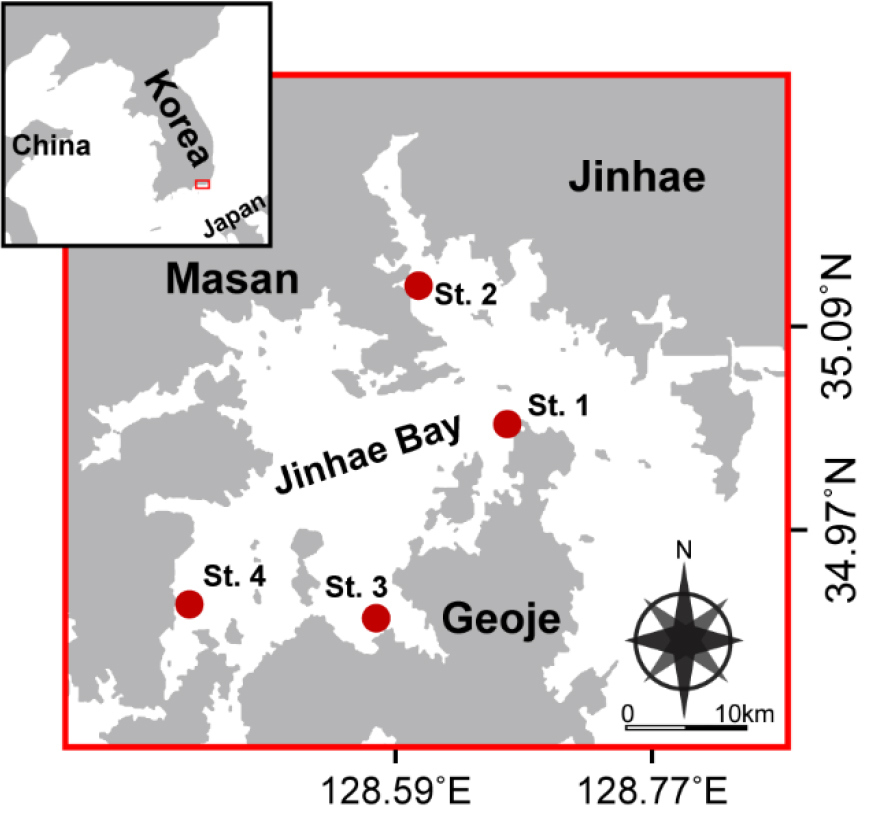
본 연구를 위해 2017년부터 2022년까지(매년 3월부터 11월까지 월 1회) 진해만의 4개의 정점에서 표층수를 대상으로 식물플랑크톤 군집 및 환경요인을 분석하였다(Fig. 1).
수온과 염분은 CTD (Sea-Bird 9, USA)를 이용하여 측정하였고 해수 중 용존산소량(Dissolved oxygen, DO)은 다항목 자동수질측정기(YSI-6600E)를 이용하여 측정하였다. 영양염 분석(용존무기질소(Dissolved Inorganic Nitrogen, DIN), PO4-P, SiO2-Si) 현장 해수를 확보하여GF/F (25 mm diameter; Whatman, Maidstone, UK) 여과지와 주사기형 여과세트로 여과한 후, 냉동상태로 보관하여 실험실로 옮겨 영양염 자동분석기(Seal analytical, Model QuAatro)로 분석하였다. 엽록소-a는 300 mL의 해수시료를 GF/F 필터(47 mm diameter; Whatman)로 여과한 후, 90% 아세톤에 24시간(4°C, 암조건) 보관하여 색소를 추출하였고, 3,000 × g에서 5분간 원심분리하여 상등액을 분리하였다. 분리한 상등액의 흡광도는 DU730 분광광도계(Beckman, Fullerton, CA)를 사용하여 측정하였다. 엽록소-a 농도는 750 nm의 조정값을 기준으로 663 nm, 645 nm, 630 nm 순으로 흡광도를 분석하여 Parsons (2013)에 따라 추정하였다.
식물플랑크톤 분석
식물플랑크톤의 정량, 정성분석은 루골(Lugol) 1% 농도로 고정된 해수시료를 사용하였다. 정량분석은 Sedgwick-Rafter counting chamber에 시료를 1 mL 분주하여 광학현미경(Axioskop, Carl Zeiss, Jena, Germany)을 이용해 200배율에서 3회 계수하여 평균을 구하였다. 정성분석은 농축된 시료를 슬라이드 글라스 위에 놓고 광학현미경 (Axioskop, Carl Zeiss, Jena, Germany) 400–1,000배율에서 검경·동정하였다. 광학현미경하에서 동정이 어려운 종은 속 수준에서 동정하였다.
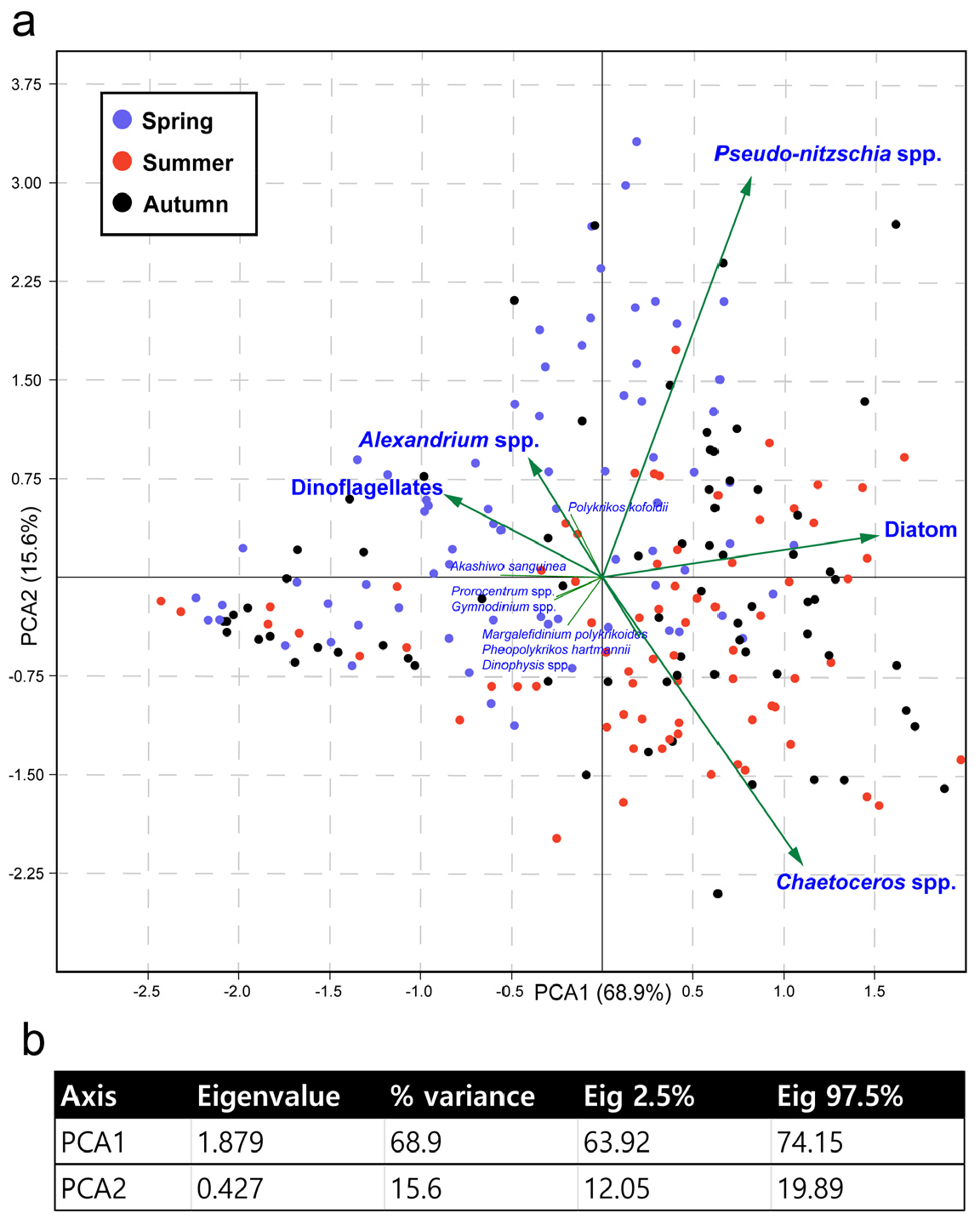
정점 별 식물플랑크톤 출현과 계절 간의 선형상관관계를 분석하기 위해 Heatmapper를 이용하였다(Babicki et al. 2016). 분석을 위해 3–5월을 봄철, 6–8월을 여름철, 9–11월을 가을철로 지정하여 식물플랑크톤 출현 종의 계절별 평균 현존량을 계산하였다. 또한, 유해식물플랑크톤에 의한 각 정점의 시공간적 분포를 설명하기 위해 Paleontological Statistics Software Package version 4.02를 이용하여 주성분 분석(Principal component analysis, PCA)을 실시하였다(Hammer 2001).
3. 결 과
수온, 염분, 용존산소, 영양염의 변화
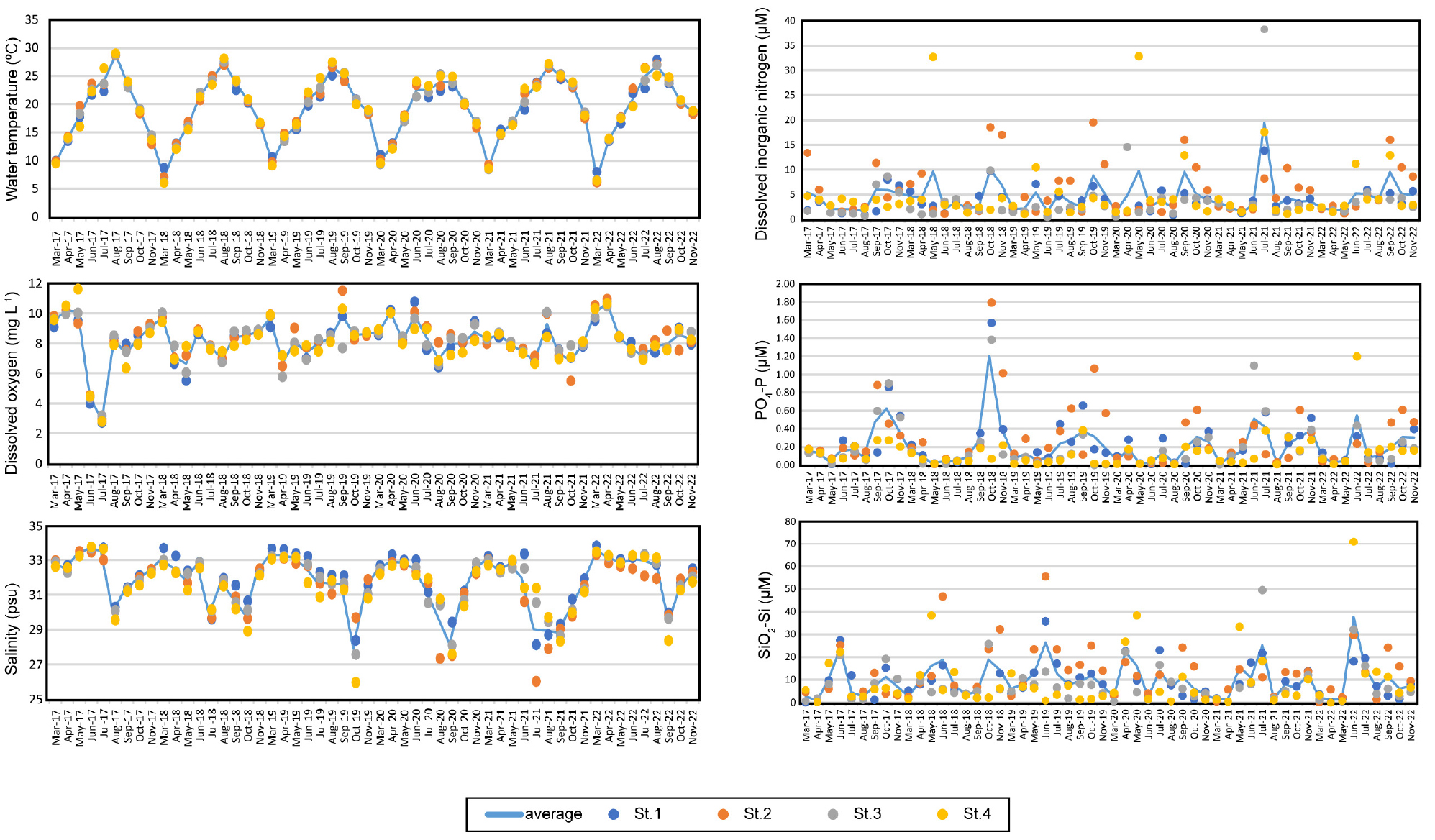
조사기간 중 각 정점의 수온, DO, 염분은 정점 간에 서로 비슷하였다(Fig. 2). 수온의 경우 6°C에서 29°C의 범위로 여름철에 상승한 수온이 가을철에 하강하는 패턴이었다. 이러한 수온의 변화양상은 6년간의 연구에서 동일하였다. 하지만 DO는 계절에 따른 일관적 변화를 보이지 않았다. 연구기간 동안 DO는 일반적으로 약 6에서 12 mg L-1의 범위로 분석되었으나, 2017년 6월과 7월에는 각각 약 4, 3 mg L-1로 연도 별 평균값에 비해 낮은 값을 가졌다. 염분은 25.9–33.8 psu의 범위를 보였으며 주로 여름에 하강하였다. 이러한 양상은 6년의 연구기간 동안 동일하였으나 2019에서 2021년의 기간동안 더 큰 하강폭을 나타내었다. 수계 내 필수 영양염(N, P, Si)을 나타내는 DIN, PO4-P, SiO2-Si의 농도는 뚜렷한 연도 및 계절별 변화 양상을 보이지 않았으나 특정한 시기 및 정점에서 크게 상승하였다(Fig. 2). 예를 들어 총 연구기간동안 모든 정점에서의 DIN의 평균농도는 4.5 μΜ이나 2021년 7월 정점 3에서는 약 8배 높은 38.2 μΜ의 농도로 분석되었다. PO4-P의 전체평균농도는 0.21 μΜ이었지만 2018년 10월 정점 2에서 약 8.5배 높은 1.79 μΜ의 농도를 보였다. SiO2-Si는 9.74 μΜ의 전체평균농도로 분석되었으나 2022년 6월 정점 4에서 약 7.2배 높은 70.9 μΜ의 농도를 나타내었다.
식물플랑크톤 현존량 및 엽록소-a 변화
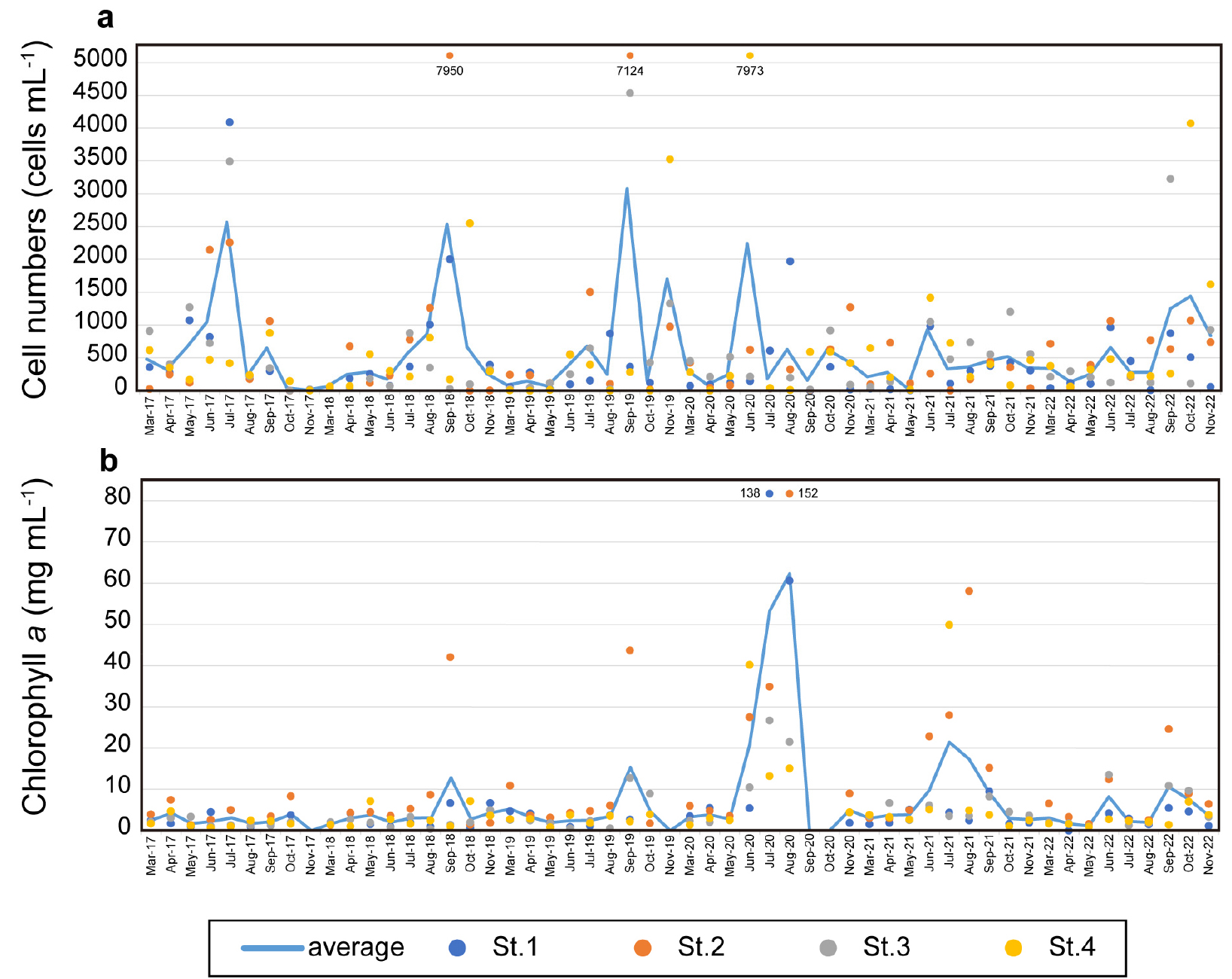
식물플랑크톤 평균 현존량은 연구기간 동안 정점 1에서 4.3 × 102 cells mL-1, 정점 2에서 7.2 × 102 cells mL-1, 정점 3에서 5.5 × 102 cells mL-1, 정점 4에서 6.5 × 102 cells mL-1로 계수되었다(Fig. 3a). 연도별 최대 식물플랑크톤 현존량을 분석한 결과, 2017년에는 7월 정점 1에서 4.0 × 103 cells mL-1 농도로 출현하였고 Chatoceros spp.가 우점하였다. 2018년에는 9월에 정점 2에서 7.9 × 103 cells mL-1의 농도로 분석되었으며, Chatoceros spp.가 우점하였다. 2019년에는 9월에 정점 2에서 7.1 × 103 cells mL-1 농도의 식물플랑크톤이 출현하였으며 Pseudo-nitzschia spp.가 우점하였다. 2020년에는 6월에 정점 4에서 7.9 × 103 cells mL-1의 식물플랑크톤이 출현하였는데 Chatoceros spp.가 우점하였다. 2021년에 기록된 최대 식물플랑크톤 현존량은 10월 정점 3에서 1.2 × 103 cells mL-1의 비교적 낮은 농도로 Chatoceros spp.가 우점하였다. 2022년에는 10월 정점 4에서 3.2 × 103 cells mL-1 농도의 식물플랑크톤이 출현하였으며, Chatoceros spp.가 우점하였다. 종합하면 연구기간동안 식물플랑크톤은 대체로 가을철에 최대 현존량을 나타내었으며, 이 때 Chatoceros spp.가 우점하는 양상을 보였다. 실제로 계절별 식물플랑크톤 평균 현존량을 분석한 결과 봄철에 2.3 × 102 cells mL-1, 여름철에 6.9 × 102 cells mL-1, 가을철에 8.4 × 102 cells mL-1로 점점 현존량이 높아지는 양상을 보였다.
엽록소-a는 식물플랑크톤 현존량의 증감과 유사한 패턴을 보였다(Fig. 3b). 구체적으로, 정점 1에서 평균 6.9 µg L-1, 정점 2에서 평균 12.7 µg L-1, 정점 3에서 평균 4.5 µg L-1, 정점 4에서 평균 5.0 µg L-1로 정점 2가 가장 높은 농도로 분석되었다. 계절별 평균은 봄철에 3.0 µg L-1, 여름철에 12.3 µg L-1, 가을철에 6.2 µg L-1로 여름에 가장 높았다.
식물플랑크톤 종조성 및 변화
연구기간 동안 식물플랑크톤 총 42속 77종의 분류군이 진해만에서 관찰되었다. 규조류가 종 조성에서 가장 많았으며 총 49종이 출현하였다. 그 다음으로는 와편모조류(27 종), 규질편모조류(1종)가 출현하였다. 정점별로는 정점 1에서 68 종, 정점 2에서 70종, 정점 3에서 70종, 정점 4에서 77종이 출현하여 정점 4를 제외하고 비슷한 출현 종수를 보였다. 2017년 6월에 53종으로 가장 많았고, 2020년도 7월에 정점 1에서 Ceratium furca 1종만이 출현하였다. 규조류는 모든 정점에서 대부분의 기간동안 우점하였다. 정점별 분석에서 와편모조류 평균 출현양은 차이가 있었는데, 정점 1과 2는 약 1.5 × 101 cell mL-1이였으나 정점 3과 4는 각각 약 5.0 × 10-1 cells mL-1, 1.0 × 10-1 cell mL-1의 출현양을 보여 최대 15배 이상의 차이로 분석되었다. 연도별 분석에서는 와편모조류는 2019년과 2020년에 각각 평균 출현 비율은 21.2 %와 16.9 % 였으나, 다른 연도들은 5% 이하의 값을 보였다. 특히 2020년 7월 정점 1과 3에서 100%의 출현비율로 분석되었으며, 이때 Ceratium furca가 우점하였다. 계절별 분석에서는 와편모조류는 봄철에 15.0 %, 여름철에 8.2 %, 가을철에 1.8 %의 출현비율을 보여 봄철에 강세를 보였다.
Heat map 분석결과 연구기간동안 출현한 식물플랑크톤 종들이 서로 다른 연도별 출현양상을 가졌다(Fig. 4). 비슷한 출현양상을 가지는 종들을 Group별로 묶은 결과, Group 1에 속하는 Chaetoceros spp., Leptocylindrus spp., Psuedo-nitzschia spp., Skeletonema costatum은 특정한 연도에 뚜렷한 강세를 보이지 않고 보편적으로 출현하였으나, 2019년 봄철에 낮은 선형상관관계를 보였다. Group 2에 속하는 생물들은 2017년도에서 2018년도까지 강세를 보였으나, 그 이후에는 거의 출현하지 않았다. 이는 Group 4에서도 동일하였다. 시간의 흐름에 따라 연속적인 선형상관관계를 보이는 식물플랑크톤 종들과는 달리, 대부분의 와편모조류는 Group 3에 속하여 특정시기에 간헐적으로 높은 선형상관관계를 보였다. 이러한 간헐적 출현은 2017년에서 2019년 사이의 기간동안 더 빈번하게 발생하였다. Group 5에 속하는 생물들은 2017년에서 2019년 까지는 특정한 시기를 선호하지 않고 보편적으로 출현하였으나, 2020년 이후로는 앞선 시기보다 낮은 선형상관관계를 가지는 것으로 분석되었다. 각 Group에 속하지 않는 종들은 비교적 고유한 출현 패턴을 가졌다. 예를 들어, 대부분의 종이 연구기간동안 2022년에 가까워질수록 낮은 선형상관관계를 보였으나, 규조류 Guinardia delicatula는 2021년과 2022년에 다른 년도보다 높은 선형상관관계로 분석되었다. 와편모조류 Ceratium fusus는 2019년과 2021년 여름에 높은 선형상관관계를 보였다. 이에 반해 Alexandrium spp.는 2017, 2019, 2020, 2021년의 봄철에 비교적 높은 선형상관관계로 분석되었다.
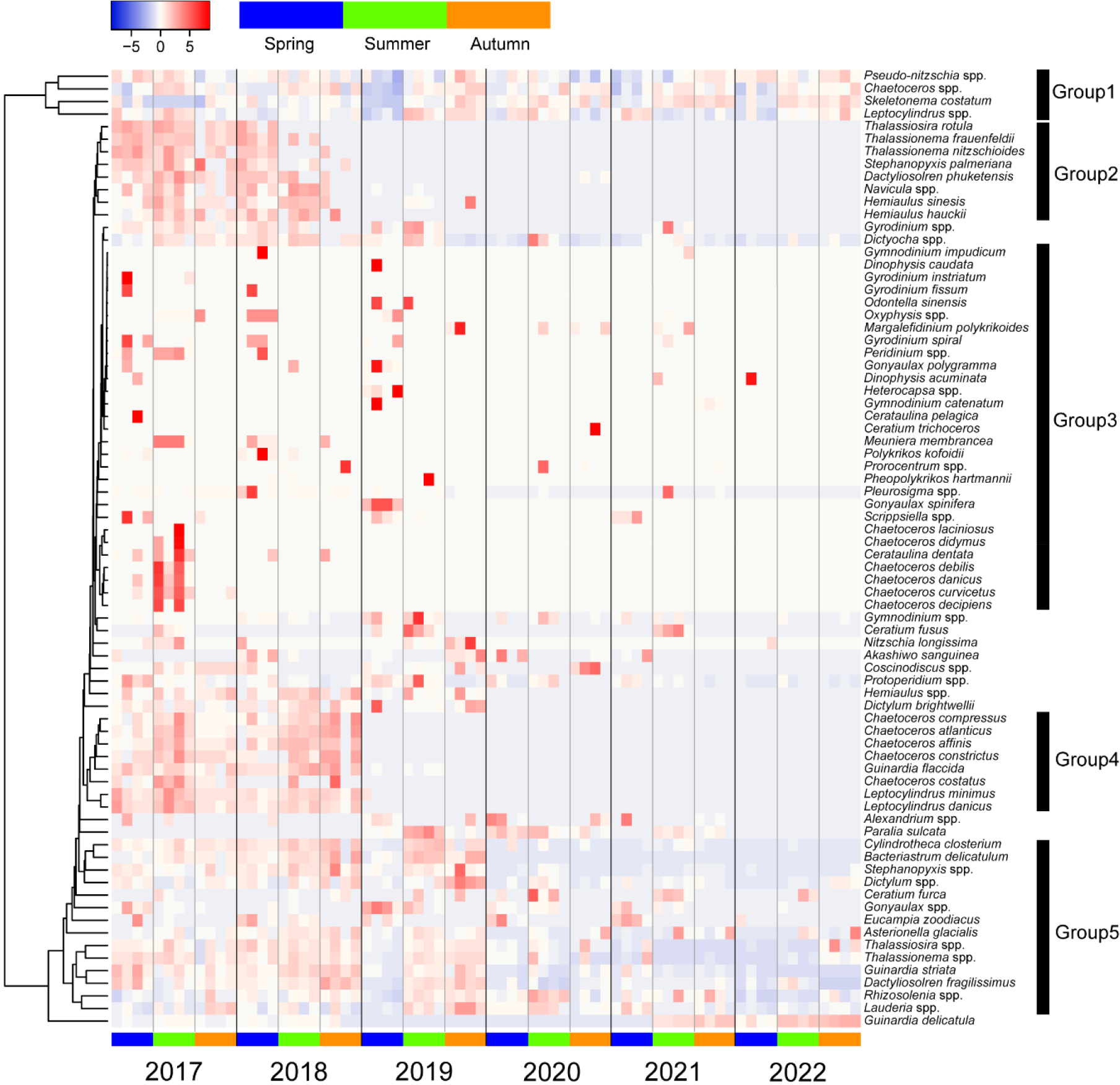
Fig. 4.
A heatmap showing correlations among seasonal samples with abundance of phytoplankton species from each station of Jinhae Bay. On the right are the species of phytoplankton for which correlations with the seasonal samples were determined. Below are the seasonal samples of the spring (blue color), summer (green color) and autumn (orange color). The four samples within each season represent St.1, St.2, St.3, and St.4 in that order. The colored scale bar indicates the degree of correlation between the variables. Red indicates a close correlation between the taxa and the samples, while light blue indicates a more distant correlation
주요 유해 식물플랑크톤 출현 양상
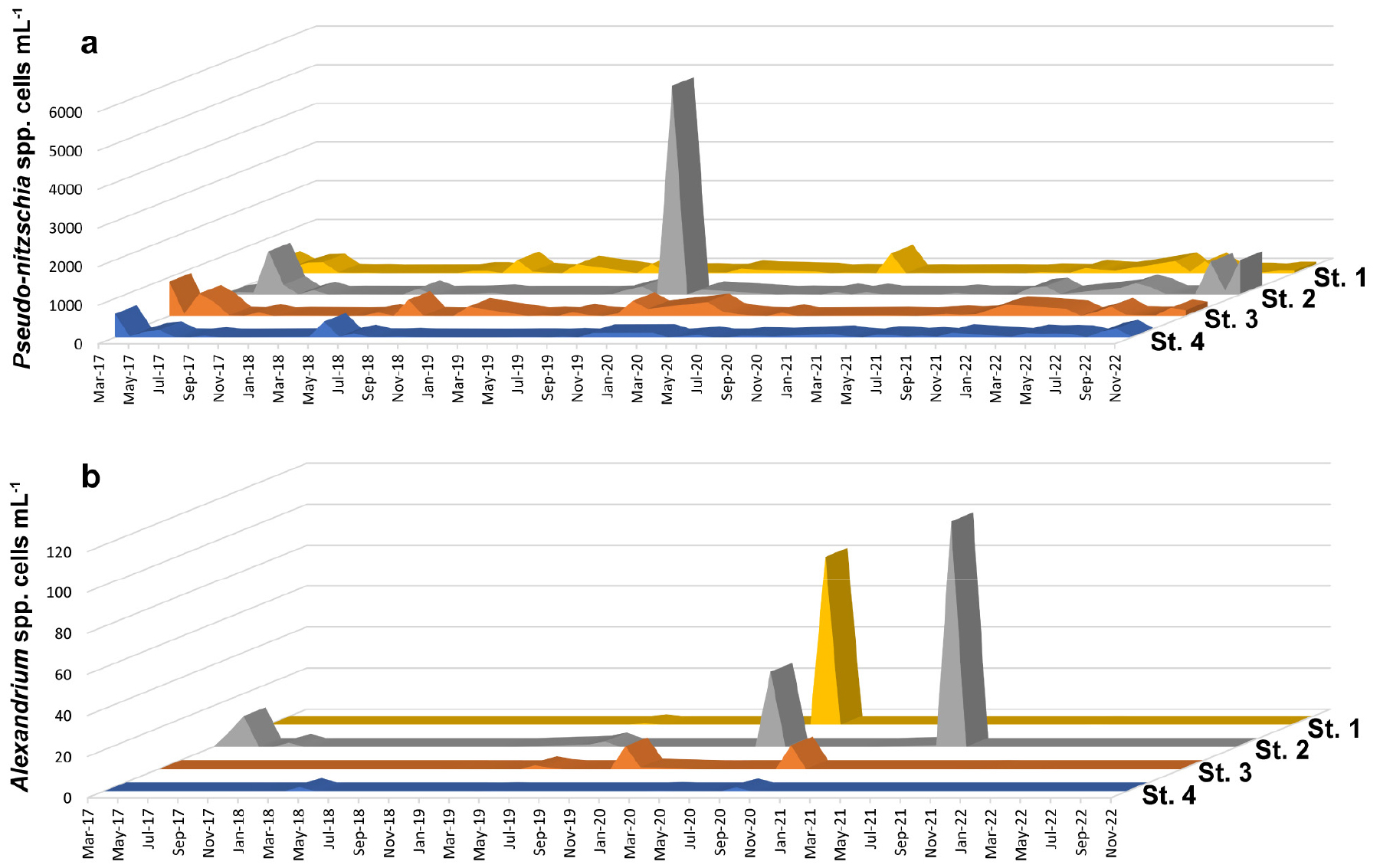
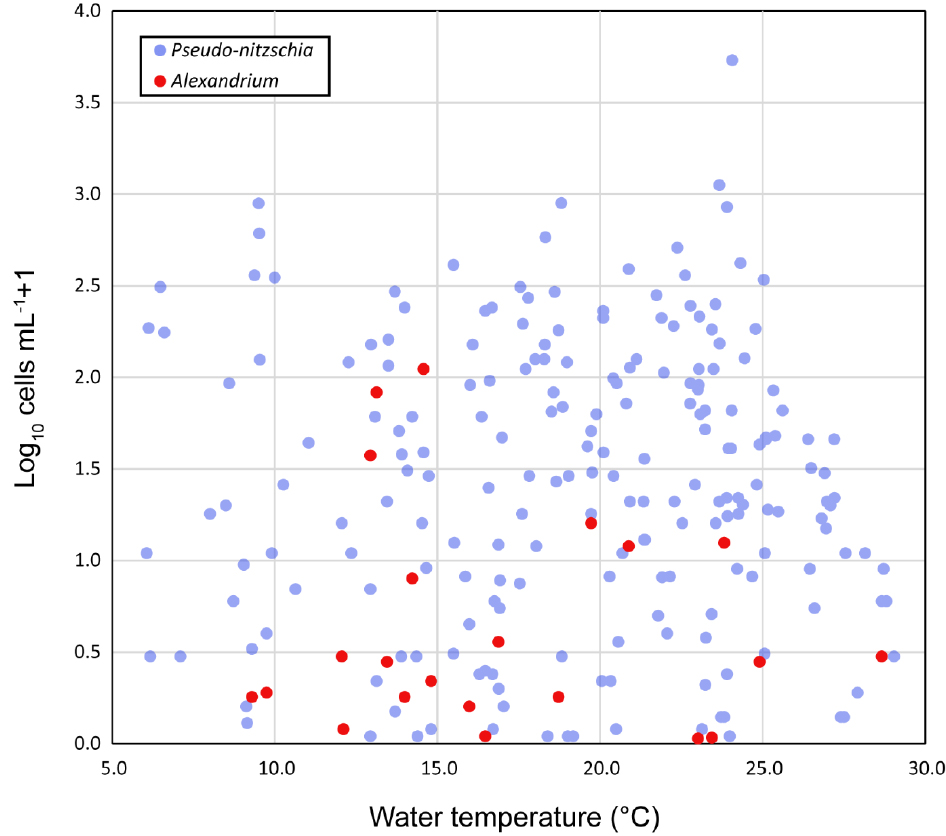
연구기간에 출현한 유해 식물플랑크톤은 규조류 1종, 와편모조류 8종으로 파악되었다. 유해 규조류 Psuedo-nitzschia는 연중 출현하였으며, 최대 현존량은 5.4 × 103 cells mL-1(정점 2, 2019년 9월) 로 파악되었다(Fig. 5a). 유해 와편모조류는 Alexandrium spp., Akashiwo sanguinea, Margalefidiniumpolykrikoides, Dinophysis spp., Gymnodinium spp., Pheopolykrikos hartmannii, Polykrikos kofoidii, Prorocentrum spp.가 출현하였다. 마비성 패류독소를 생성하는 것으로 알려진 Alexandrium은 주로 봄철에 출현하였으며, 정점 1과 2에서 각각 8.2 × 101 cells mL-1(2020년 4월), 1.1 × 102 cells mL-1(2021년 4월)의 높은 현존량을 보였다(Fig. 5b).
유해 식물플랑크톤의 출현양상은 주성분 분석에서 계절적 요인과 높은 상관성을 보였다(Fig. 6a). 주성분 분석결과, PCA1은 68.9%의 변이를 보이며 봄철과 여름철 시료를 분리하였고, 각각 와편모조류와 규조류가 주성분으로 작용하였다. PCA2는 15.6%의 변이를 보이며 Psuedo-nitzschia와 Chaetoceros spp.가 주성분으로 작용하여 각 정점을 분리하였다(Fig. 6b). 규조류 Psuedo-nitzschia와 와편모조류 Alexandrium은 수온에 따라 서로 다른 출현양상을 보였다(Fig. 7). Psuedo-nitzschia (6.0–29.0°C)와 Alexandrium (9.1–28.6°C) 모두 넓은 수온 적응범위를 보였으나, 두 유해 식물플랑크톤의 대발생을 유도하는 적정 수온이 다르게 파악되었다.
4. 고 찰
식물플랑크톤 발생 및 군집의 종조성은 빛, 온도, pH 및 영양염류와 같은 다양한 환경요인에 민감하게 반응하므로, 수질변화를 감지하는 생물학적 지표로 사용되어 왔다(Peng et al. 2012; Lee et al. 2023). 이중 식물플랑크톤의 대발생을 유발하는 데 필요한 조건은 불확실하지만, 환경요인과 식물플랑크톤 종조성에는 유의미한 상관관계가 존재한다(Sathyendranath et al. 2015; Grigorszky et al. 2017; Oliveira et al. 2020). 이는 역으로 특정 식물플랑크톤의 출현은 서식지의 수질 및 환경변화에 의해 발생하는 것으로 해석될 수 있다. 따라서 식물플랑크톤 모니터링은 유해조류 적조현상을 제어하고 해양 생태계의 건강성을 평가하는 데 있어 중요하다(Jia et al. 2022). 본 연구는 최근 6년간의 진해만에서 출현한 유해식물플랑크톤의 종류를 밝히고 이들의 출현양상을 보고함으로, 장기간의 식물플랑크톤 변화를 분석하기 위한 기초자료를 제시하였다.
식물플랑크톤은 서로 다른 생태학적 지위를 가지며, 계절에 따른 수질변화는 생물의 천이를 유발한다(Alley 1982). 본 연구에서 샘플링 기간 동안 규조류 및 와편모조류는 서로 다른 출현양상을 보였다. 규조류 Chaetoceros 및 Psuedo-nitzschia는 보편적으로 존재하며 하계에 대발생하는 경향을 보였으나, 와편모조류는 춘계에 간헐적인 적조를 발생시켰다. 특히 와편모조류 종들의 전체적인 출현량은 2019년 봄철에 뚜렷한 강세를 보였는데 이때Chaetoceros 및 Psuedo-nitzschia와 같은 규조류는 낮은 출현양이었다(Fig. 4) 이는 와편모조류와 규조류가 선호하는 환경이 다름을 의미한다. 계절적 차이 이외에도 진해만은 공간적 차이가 뚜렷한 지역으로 식물플랑크톤의 출현에도 영향을 미친 것으로 분석되었다(Kwon et al. 2014). 외해수와의 교류가 상대적으로 잦은 정점 1, 2에서는 주로 와편모조류에 의한 적조가 발생하였으나, 담수유입의 양이 많아 영양염이 풍부하고, 유속이 느린 것으로 알려진 정점 3, 4에서는 와편모조류가 약세를 보였다(Lee 1993; Kwon et al. 2014). 이는 규조류와 와편모조류의 영양염 반응에 대한 특성 및 경쟁관계에 의한 것으로 보인다(Smayda 1997). 규조류는 영양염 반포화 계수가 높아 영양염 요구성이 큰 조류로 높은 영양염 조건에서 와편모조류보다 빠르게 성장할 수 있다(Smayda 1997; Baek et al. 2008). 이에 반해 와편모조류는 영양염 농도가 낮은 환경에서도 성장이 가능해 상대적으로 영양염이 낮은 정점 1, 2에서 생리적 이점을 가졌을 가능성을 시사하였다 (Smayda 1997).
진해만의 적조는 1981년 7월에 발생한 Chaetoceros sp.의 대발생 이후로 지금까지 다양한 종이 출현하여 시기별로 우점종이 다른 특성을 보여왔다(이 등 2023). 예를 들어, 독성 와편모조류인 Karenia mikimotoi는 1970년대부터 1980년대까지 주로 출현하였으나(이 등 2023), 본 연구에서는 출현하지 않았다. 1990년도 이후에는 Margalefidinium polykrikoides에 의한 적조현상이 두드러져 2008년도까지 이어졌으나 그 이후 출현 빈도가 감소하였다(Lee et al. 2013). 본 연구 기간 동안 출현한 M. polykrikoides 세포 농도는 최대 7.2 × 10-1 cell mL-1로 국립수산과학원의 적조경보기준(1.0 × 103 cell mL-1)에 비해 1/130에 해당되는 낮은 농도를 유지하였다. M. polykrykoides 출현의 감소는 식물성 플랑크톤 생장에 필수적인 요소인 수온, 염분 및 영양소 수준의 변화로 인해 영향을 미칠 수 있다. 특히, DIN, PO4-P, SiO2-Si 등의 영양소는 식물성 플랑크톤의 성장과 증식에 중요한 역할을 한다(Peng et al. 2012). 이러한 영양소의 감소는 M. polykrykoides에 의한 적조현상에 필수적인 자원의 공급을 제한할 수 있다(Gobler et al. 2008). 실제로 M. polykrykoides 적조현상은 질소 농도가 높은 지역과 관련이 있다(Gobler et al. 2008).
본 연구 기간 동안, 와편모조류의 경우 Alexandrium 및 Ceratium에 의한 적조가 주를 이루었으며 다른 유해 와편모조류 종들은 미량만이 출현하였다. 2007년 오염총량관리제 등 오염저감 정책 실시 이후 진해만의 수질이 개선되었는데, 이러한 수질변화가 종조성 변화에 영향을 끼쳤을 것으로 사료된다(Cho and Yang 2012). Alexandrium은 질소 고갈 시, 질소를 세포 내에 축적하는 능력이 있으며, 혼합영양을 통해 다른 식물플랑크톤 및 박테리아를 섭식하여 낮은 영양 조건에서 유리한 생장특성을 보인다(Collos et al. 2004; Purz et al. 2021). 마찬가지로, Ceratium 속의 종들은 종속영양을 통해 영양소를 얻을 수 있으며, 이는 인 제한 조건에서 개체군을 유지하는데 기여한다(Baek et al. 2008). 즉, 빈영양상태에서 다른 종들에 비해 경쟁 우위에 있는 Alexandrium 및 Ceratium이 연구기간 동안 적조를 발생시킨 것으로 사료된다(Smayda 1997; Collos et al. 2004; Purz et al. 2021). 진해만의 Alexandrium 및 Ceratium 등의 유해 식물플랑크톤의 출현은 해양 생태계의 균형을 깨뜨리고, 공공 건강에 위협이 될 수 있으며, 환경 변화의 지표가 될 수 있다(Shin et al. 2014). 예를 들어 Ceratium의 대발생 이후 세포가 부패하면서 많은 양의 산소를 소비해 저산소증이 유발될 수 있으며 어류, 무척추동물 및 기타 해양 동물군과 같은 해양 생물에 해로운 영향을 미칠 수 있다. 본 연구에서는 2020년 7월에 Ceratium에 의한 적조가 발생하였으나, 실제 저산소증 현상까지는 이어지지 않았다.
Alexandrium은 대표적인 유해조류로 마비성 패류독소를 생성하는 것으로 알려져 있어, 각별한 주의가 필요하다(John et al. 2014). 본 연구에서 Alexandrium에 의한 적조현상은 봄철에 관찰되었으나(Shin et al. 2014), 여름 및 가을에도 미량의 Alexandrium 세포가 진해만에서 검출되었다. 9.1°C에서 28.6°C의 범위에서 Alexandrium이 출현하였는데, 이는 단일종에 의한 출현이 아닌 다수 종에 의한 계절적 천이 현상으로 분석된다. 적조의 원인이 되는 플랑크톤의 휴면포자는 종마다 발아 온도가 다르다(Shin et al. 2014, 2021). 예를 들어, 진해만에 발생하는 마비성 패류독소의 원인이 되는 A. catenella의 휴면포자 발아온도는 10°C인 반면, A. pacificum은 10–25°C의 온도범위에서 발아할 수 있다(Shin et al. 2021). 이외에도 무독성 종인 A. affine는 20°C의 수온에서 최대 발아율을 보였으나, A. insuetum은 25°C의 수온에서 최대 성장률을 보였다(Band-Schmidt et al. 2003; Shin et al. 2014). 이는 서로 다른 Alexandrium spp.의 휴면포자가 최적 수온에 발아하면서 독성 종과 무독성 종이 동시 출현할 수 있음을 의미한다. 따라서, 적조 및 패류독소 발생을 조기에 경고하고 대응하기 위해서는 종 수준에서의 Alexandrium 출현 패턴 및 최적 수온 범위에 대한 연구가 필요하다.
Alexandrium 속은 분류학적으로 현재 33종이 보고되었다(Guiry and Guiry 2023). 하지만 이들 중 일부 종만이 패류독소 발생의 원인이 됨으로, 환경 모니터링 시 독성종과 무독성 종을 구분하여 검출하는 것이 중요하다. 본 연구에서는 현미경 관찰을 통해 Alexandrium 속을 조사하였기 때문에, 형태학적 유사성이 높은 독성 종과 무독성 종을 구분하는데 한계가 있었다. 이들을 형태학적으로 종 수준으로 동정하기 위해서는 종구에 위치한 각판의 배열 및 정단부의 세부구조를 전자현미경을 이용해 분석해야 한다(Balech and Tangen 1985). 하지만 전자현미경을 이용한 분석은 환경모니터링 시, 정량적 분석에 한계가 존재한다. 최근 분자생물학적 기술 발달과 함께 형태학적으로 모호한 Alexandrium 종들의 분자적 동정을 가능하게 하였다(John et al. 2014). 이어서 실시간 중합효연쇄반응(quantitative real time polymerase chain reaction, qPCR)과 같은 분자모니터링 기법이 등장함에 따라 적조 및 패독 원인 종의 환경모니터링 정확도가 높아질 것으로 기대되고 있다. 일부 Alexandrium 종은 독력이 높아 미량으로도 마비성 패독을 발생시킬 수 있어, 검출 민감성 및 정확도가 높은 분자모니터링 기반 장기 분석이 필요하다.
5. 적 요
본 연구는 2017년부터 2022년까지 진해만 4개 정점의 월별 시료를 분석하여 최근 남해안 식물플랑크톤 군집구조의 계절별 변화 양상을 파악하였다. 각 정점에서 영양염류를 제외한 다른 환경요인은 그 수치가 유사하였다. 수온 변동은 6.0–29.0°C으로 확인되었고, 용존산소량은 2.7–11.6 mg L-1의 범위를 보여 전형적인 온대기후의 환경 패턴을 보였다. 염분은 25.9에서 33.8의 범위를 형성하였다. 식물플랑크톤 현존량은 5.0 × 10-1–7.9 × 102 cells mL-1의 범위를 보였고, 각 정점의 엽록소-a 또한 현존량과 비슷한 패턴을 보였다. 총 42속 77 종의 식물플랑크톤 분류군이 기록되었으며, 규조류 49종, 와편모조류 27종 그리고 1종의 규질편모조류로 구성되었다. 규조류는 모든 정점과 계절에서 우점하였다. 반면, 와편모조류는 봄철에 간헐적으로 적조를 형성하였다. 연구기간동안 9종의 유해조류를 검출하였는데, 규조류 Psuedo-nitzschia와 와편모조류 Alexandrium spp., Akashiwo sanguinea, Margalefidiniumpolykrikoides, Dinophysis spp., Gymnodinium spp., Pheopolykrikos hartmannii, Polykrikos kofoidii, Prorocentrum spp.가 조사되었다. 이들 유해 식물플랑크톤의 출현양상은 계절적 요인과 높은 상관성을 보였다. 본 연구는 진해만 식물플랑크톤의 종류 및 계절별 변화를 분석한 것으로, 향후 진행될 후속 연구와 환경변화에 따른 남해안 유해 식물플랑크톤의 장기간 변동을 이해하기 위한 좋은 기초 자료가 될 것이다.