1. 서 론
2. 재료 및 방법
3. 연구지역 개황
4. 결 과
환경 조건
서식밀도와 월별 생장
성장률 및 생산량
5. 고 찰
서식 환경
발아조건
생장 양상
생체량 변화 및 생장율
생산량 추정
1. 서 론
칠면초(Suaeda japonica)는 명아주과에 속하는 일년생 식물로 동아시아에서 서식한다. 염분농도가 높은 니질 또는 사니질 갯벌이나 해안, 내륙의 염지 등 8 m 전후의 조차를 보이는 공간을 선호하는 염생식물이다(Lee et al. 2016). 주로 저위 간사지에서 순군락을 형성하며 고도가 높아질수록 퉁퉁마디, 갯잔디 등과 혼생한다(임 등 1995; 민 1998). 체내의 수분 잠재량을 낮게함으로써 다른 명아주과 식물에 비해 잦은 빈도의 장시간 침수에 견딜 수 있으며(민 1998; 류 2009), 퇴적물의 염분농도가 12.71 g/kg에서 가장 잘 생장하고, 그 이상의 고염분에서도 생존이 가능하다(Cui et al. 2008; Akira and Tomoko 2018). 하지만 밀물에 의한 침수시간이 8시간 이상으로 길어지면 생육할 수 없고(민 1998) 건조에 대한 내성도 일부 염생식물에 비해 약하여 토양의 함수량에 따라 크기나 잎사귀 형태가 상이한 모습이 나타나기도 한다(민 1998). 만조시 침수되고 간조시 건조한 환경이 반복적으로 발생하는 저염습지에 서식하기 때문에(Keisuke and Sakae 2010) 다른 염생식물보다 일찍 발아하고 생장 초기에 지하경(뿌리)이 지상경(줄기)보다 빠르고 광범위하게 자란다(Lee and Ihm 2004). 칠면초 관련 연구는 주로 염분 조건에서 생장양상을 파악하기 위해 서식조건과 환경에 따른 생장 및 생리기능에 대해 진행되었는데, 염습지 내에서 적정 서식지 조건을 결정하기 위해 염도에 대한 종자 발아 및 생장(Akira and Tomoko 2018), 염분에 따른 생리 특성(Choi et al. 2014), 염분 농도에 따른 발아 전략(Li et al. 2011), 토양 비중, 공극, 나트륨 흡착율 등 칠면초의 생육에 미치는 요인(류 2009) 등과 개체군 특성을 파악하기 위한 칠면초의 분포 특성과 군집에 생물학적 상호 작용(Lee and Ihm 2004), 해역에서 종자 확산과 식생을 유지할 수 있는 원인(Min 2005), 환경에 따른 칠면초의 개체수와 체장변화와 월별 생체량에 대한 연구(Kim 2009; Kim et al. 2010) 등이 진행되었다. 최근 해양 탄소 격리에 대한 관심으로 블루카본으로써 염생식물의 가치가 높아지고 있으며, 생장과 생산성을 파악하기 위한 다양한 생장 요인에 대한 연구가 진행되고 있다. 따라서 국내 서·남해안 특히 강화도 부근 펄 조간대에서 폭넓게 분포하는 칠면초를 대상으로 탄소 격리 정보를 확보할 수 있는 연간 생장률과 생산력 및 탄소량을 추정하였다. 또한 3년간의 생장률과 생산력을 비교하여 식물의 생장에 영향을 미치는 요인을 분석하였다.
2. 재료 및 방법
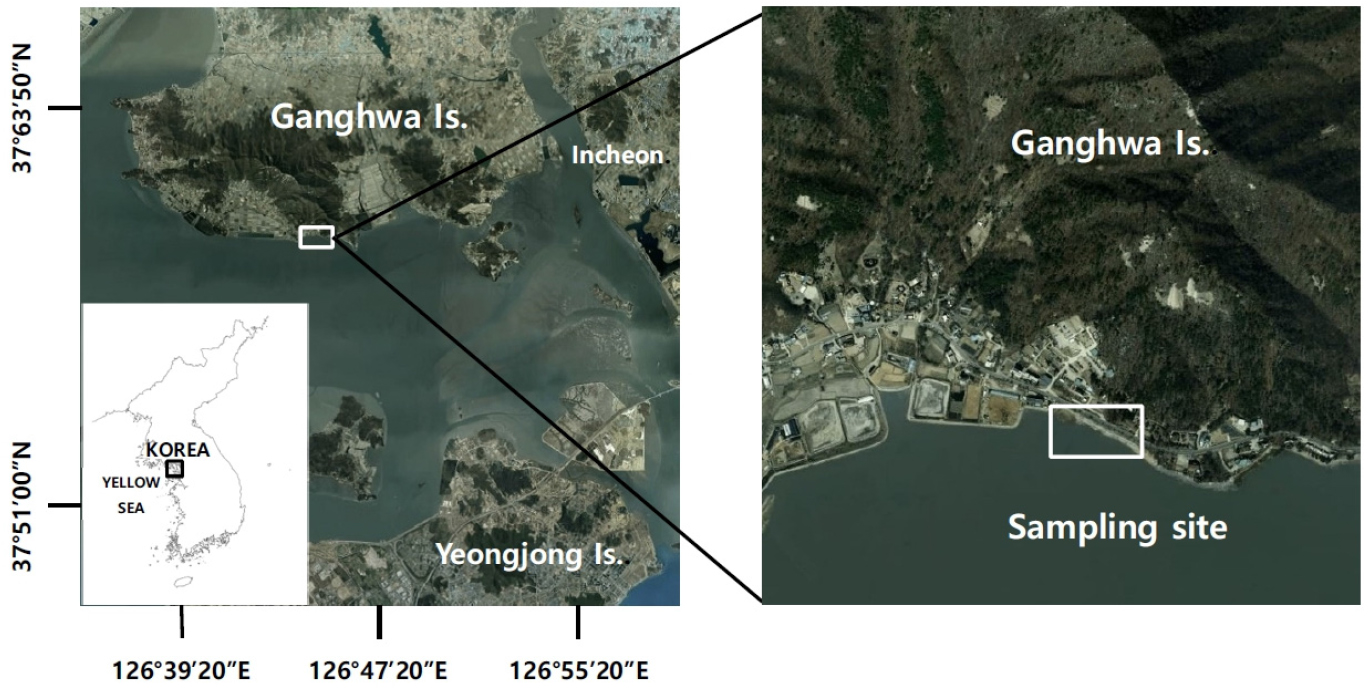
현장 조사는 강화도 남동부에 위치한 강화군 화도면 동막리 갯벌조간대(37°35'39"N; 126°26'50"E)에서 진행하였다(Fig. 1). 실험대상종인 칠면초는 연중 2월부터 10월까지 생존하는 종으로, 조사기간은 2018년도부터 2020년까지 매년 2월부터 10월까지로 설정하여 약 3년 동안 월별 조사를 수행하였다. 매년 7월에 2개 지역에 정선을 선정하여, Real-time Kinematic (RTK)을 이용하여 서식 최대 조위를 측정하였으며, 유기물 함량과 입도조성 분석을 위해 표층 퇴적물을 채취하였다. 유기물 함량은 시료를 건조한 후에 CHN 분석기(FlashEA 1112 NC Analyzer, Thermo Fisher Scientific Inc., Waltham, MA, USA)를 사용하였으며, 입도조성은 전처리 이후 입도분석기(Mastersizer 3000, Malvern Panalytical Ltd, Malvern, Worcestershire, U.K)를 활용하여 평균 입도조성을 산정하였다. 지역 환경 정보 중 기온, 강수량, 일조 시간은 기상청 기상자료개방포털의 관측 자료를 활용하였다(기상청 2020). 칠면초 채집은 매월 채집이 이루어지지 않은 동일 군락 지역에 1 m × 1 m 방형구를 설치하고, 방형구내의 모든 개체를 지하부까지 채집하였다. 채집된 칠면초는 퇴적물을 세척한 후에 실험실에서 살아있는 개체와 죽은 개체를 분리하였다. 살아있는 개체는 잎의 색과 부착여부를 통해 파악하였으며, 분석에는 살아있는 개체를 이용하였다. 줄기와 뿌리의 길이를 측정하였고, 뿌리(지하경)와 줄기(지상경)를 퇴적물이 침적되는 부분을 기준으로 절단하여 분리한 후에 각각 습중량(wet weight)을 측정한 후 건조기에서 60℃로 72시간 건조하여 건중량(dry weight)을 측정하였다. 탄소량 측정을 위해 건조된 시료 중 일부를 골라내어 블랜더로 곱게 간 다음 10–15 mg 정도를 추출하여, CHN 분석기로 탄소량을 측정하였다. 식생 성장에서 생체량은 생산성을 평가하기 위한 기준이 되며, 특히 수분은 탄소량을 환산하기 위해서는 제거되어야 하므로 건중량을 측정한 후에 탄소량을 산정하였다. 따라서 생체량을 이용한 모든 분석에는 건중량을 사용하였다. 측정된 자료를 대상으로 생장률(Grantz et al. 2006)과 생산량(Holme and Mclntyre 1984)을 추정하였고, 칠면초의 생장과 환경요인의 상관분석에는 IBM SPSS statistics 27을 사용하여 분석하였다.
생장률 GR = (ln B2 - ln B1)/(t2 - t1),
Bi: t기간의 전체 식물 평균 중량, t1, t2: 채집 시기
생산량 P = ∑∑Giwi∆t,
Gi: t 기간 동안 순간 생장율, wi는 t기간 동안 무게(건중량) 변화
3. 연구지역 개황
강화도 남동부 갯벌은 한강 수계와 예성강 하구 인근에 위치하여 담수와 해수의 순환에 의해 하구로 운반된 퇴적물에 의해 형성되었다(한국해양연구원 1998; Lee et al. 2007). 조석은 전형적인 반일주조로 최대 조차가 10 m를 나타내면서, 최간조시 육지로부터 최대거리 6 km 까지 갯벌이 드러난다(Woo 2013). 조석에 따른 담수와 해수의 혼합으로 해수는 염분 구배가 뚜렷한 기수 특성이 나타난다. 대상 해역은 노출시간이 3–5시간이고, 퇴적상은 펄 퇴적물이 우세하면서 생물교란작용에 의하여 퇴적물이 뒤섞여 있다. 계절에 따라 퇴적과 침식이 반복되는, 상향 조립화 층서(coarsening-upward sequence)를 나타낸다(Woo and Je 2002; Yoo and Choi 2005). 또한 풍부한 유기물과 영양염을 보유하는 하구 갯벌로 분류되어, 다양한 해양생물의 서식처로서 중요한 기능을 담당하는 지역이다(해양수산부 1998; Mok et al. 2005). 해수욕장과 암반지역을 제외한 대부분의 해안에 매립이 진행되어, 옹벽이 축조되어 있으며, 일부 구성된 해안가 퇴적물 지역과 평탄한 갯벌에 칠면초 순군락이 넓게 발달되어 있다(Shim et al. 2002), 조간대 상부 해안선을 따라 지채(Triglochin maritimum), 갯골풀(Juncus haenkei) 등이 서식하고, 최상부에는 갈대(Phragmites communis)가 분포하며, 해안가 상부와 해안선을 따라 천일사초(Carex scabrifolia), 해홍나물(Suaeda maritima), 갯질경(Limonium tetragonum) 등이 군락을 이루고 있다(Lee et al. 2016). 또한 칠면초가 서식하는 지역에 외래종 유해식물로 지정된 갯끈풀(Spartina anglica)이 집단 서식하고 있어서, 매년 절단 및 제거 작업이 진행되고, 이러한 과정에서 칠면초 서식과 생장에 불리한 영향을 미치는 것으로 평가되고 있다.
4. 결 과
환경 조건
조사해역에서 연간 기온변화는 2018년에 -5℃–26.7℃로 가장 큰 편차를 보였다. 2020년에는 -1.2℃–25.3℃로 2018년에 비해 적은 편차를 나타냈다(Fig. 2a). 매년 월별 평균 기온은 유사하였고, 1,2월과 7월은 차이를 나타내어, 월 평균 기온 변화는 최저 -5℃ (2018년 1월)에서 최고 26.7℃ (2018년 8월)로 연간 30도 이상의 편차를 기록하였다. 강수량은 해마다 차이를 보였고, 2018년 8월에 높은 강수량을 보였고, 장마가 나타나는 7월에 상대적으로 낮은 강수량을 나타냈다. 2019년 7월과 9월에 높은 강수량을 보였고, 8월에는 상대적으로 가장 낮았다. 2020년 8월(480 mm/월)에 다른 연도에 비해 2배에 이르는 높은 강수량을 보였고, 7월에도 높은 강수량을 나타냈다(Fig. 2b). 일조시간은 강수량과 상반되는 양상으로 2018년에는 월평균 200.0 hr에 이르는 일정한 일조시간을 나타남에 비해 2020년에는 3월(254.7 hr)과 4월(280.6 hr)에 높게 나타났으며, 8월에 73.9 hr로 다른 연도에 비해 낮은 일조시간을 나타냈다(Fig. 2c). 서식 지역의 퇴적 유기물함량은 2.9–3.2%로 월별 또는 연간 변화가 크게 나타나지 않았으며, 입도조성에서도 5.9–6.2 φ로 시간에 따른 변화가 거의 나타나지 않았다. 환경요인과 칠면초 생장과의 관계를 파악하는 상관분석에서 일조시간을 제외한 평균기온과 강수량에서만 유의한 상관관계를 나타냈지만, 교차상관분석에서는 서식밀도와 기온(r = 0.711), 지하부와 지상부 생체량과 온도(r = 0.753, 0.813)에서 유의한 상관관계를 나타냈다(Table 1).
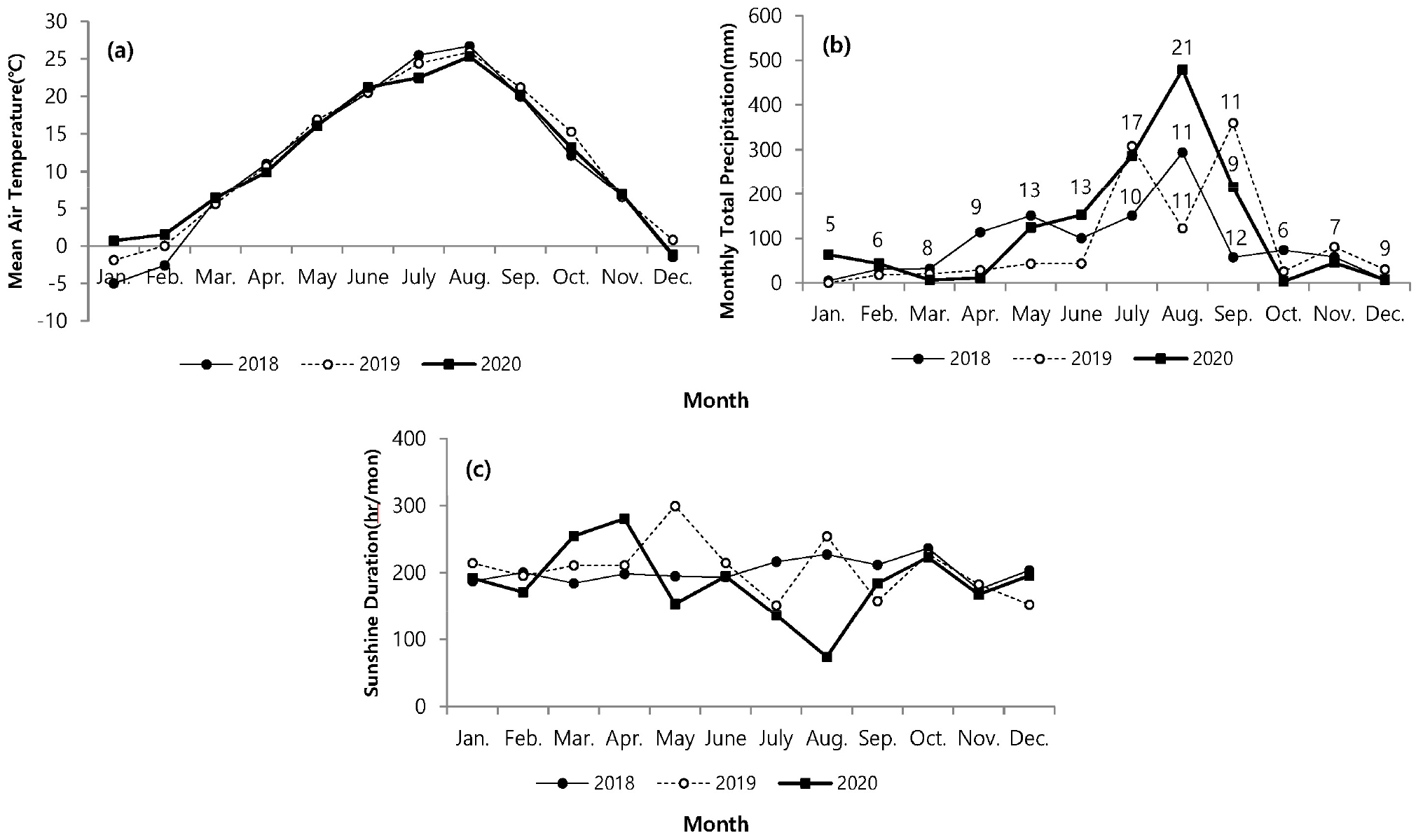
Fig. 2.
Monthly variation of weather condition such as mean temperature (a), precipitation (b) and Sunshine duration (c) on Ganghwa Isl. at each year. Number referred to ranning days, January to June and October to December are represented by the mean number of rainy days. (The data for this figure is modified by Korea Meteorological Administration)
Table 1.
Analysis of cross correlation between climate factors and growth characteristic in S.japoinca
서식밀도와 월별 생장
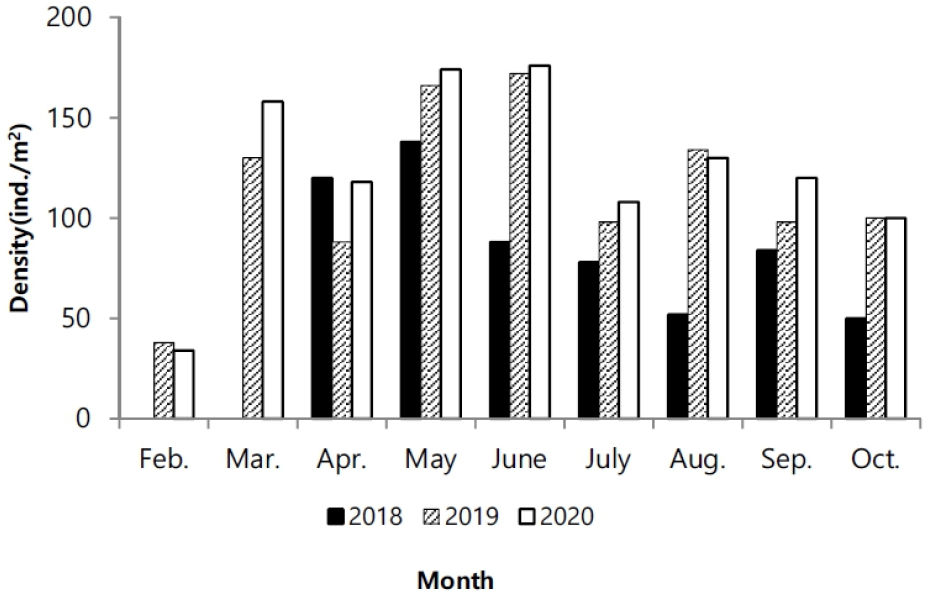
연도별 서식 밀도는 각각 610개체/m2 (2018), 1024개체/m2 (2019), 1118개체/m2 (2020)로, 2020년도에 가장 높았다. 월별 채집된 서식 밀도는. 2월에 0–38개체/m2로 가장 적은 서식밀도를 나타냈고 5–6월에 높은 서식밀도를 보였다가 7월 이후에 서식밀도가 감소하였다. 2018년의 경우 2월과 3월에 개체가 채집되지 않았다(Fig. 3).
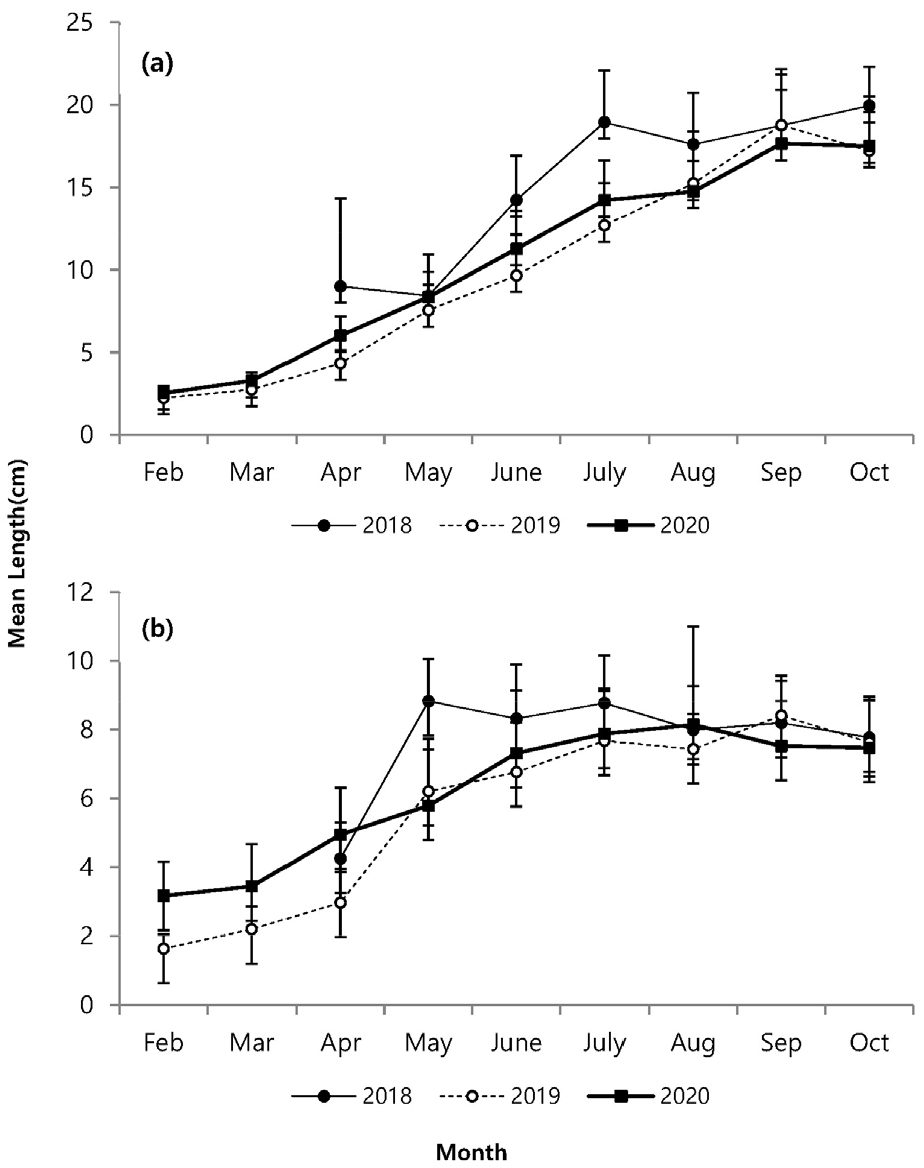
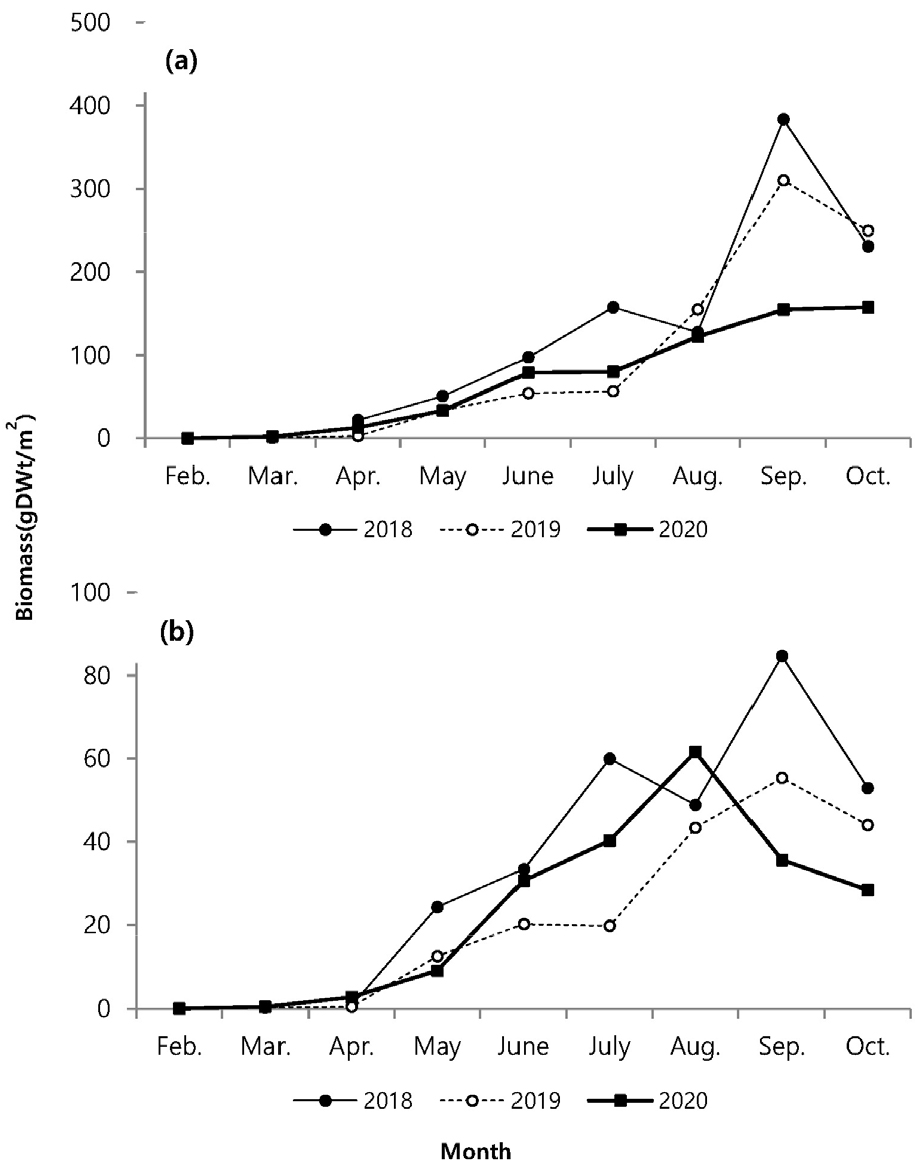
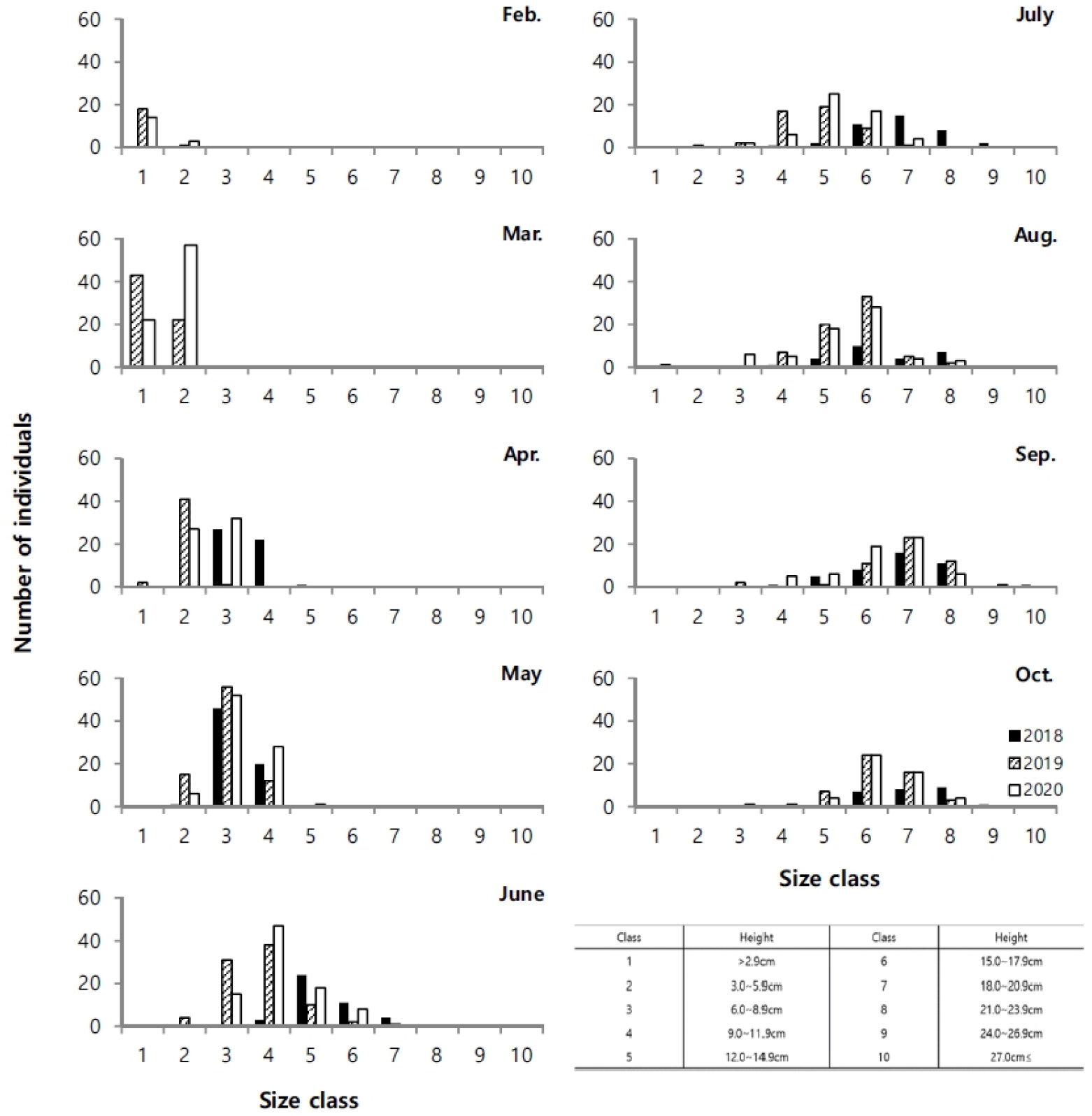
지상경(줄기)과 지하경(뿌리)을 분리하여 비교한 길이 생장에서 매월 꾸준한 생장 증가를 나타내다가 8월 이후 생장이 감소하였다(Fig. 4). 지하경은 지상경과 유사한 생장을 나타냈지만 4월 이후 급격한 생장을 보였고, 6월 이후 거의 생장이 진행되지 않았다. 지상경은 발아이후 9월까지 완만한 생장을 나타냈다. 연도별 생장에서 2018년이 다른 시기보다 지상경에서 4월부터 높은 생장을 나타내면서, 다른 연도에 비해 가장 높은 생장을 나타냈고, 지하경에서도 5월에 가장 높은 생장을 나타내다가 6월부터 생장 비율이 감소하였지만 다른 시기보다는 높은 생장을 나타냈다. 생체량은 지상경이 8월까지 완만한 증가를 나타내다가 9월에는 급격히 증가하고 10월에 감소하였으며, 지하경에서는 4월 이후 증가하는 양상을 보이다가 2020년에는 8월 이후, 기타 연도에는 9월에 감소하였다(Fig. 5). 월별 길이빈도 분포에서 5월까지는 일정하고 3–11.9 cm의 한정된 범위에서 생장을 하다가, 6월 이후 각 개체마다 크기 분포 범위를 폭넓게 확대하였다. 7월 이후에는 생장이 빠른 개체가 나타났고, 가장 광범위한 빈도분포를 보였다. 8월까지도 새롭게 발아하는 개체도 관찰되었다(Fig. 6). 8월까지 크기 등급별로 평균 생장이 다소 증가하였으나, 9월 이후 생장이 저조하다가 10월과 유사한 분포를 나타냈다.
성장률 및 생산량
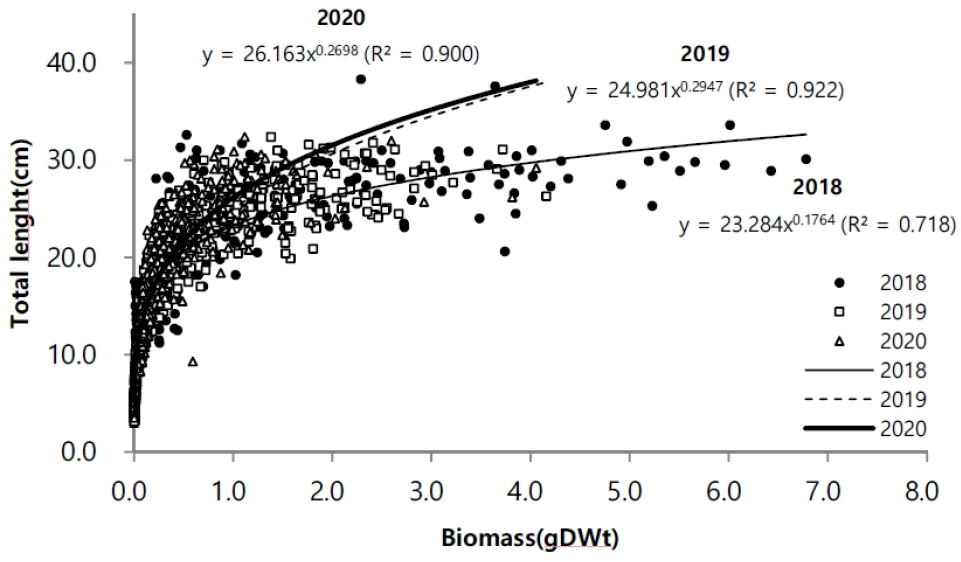
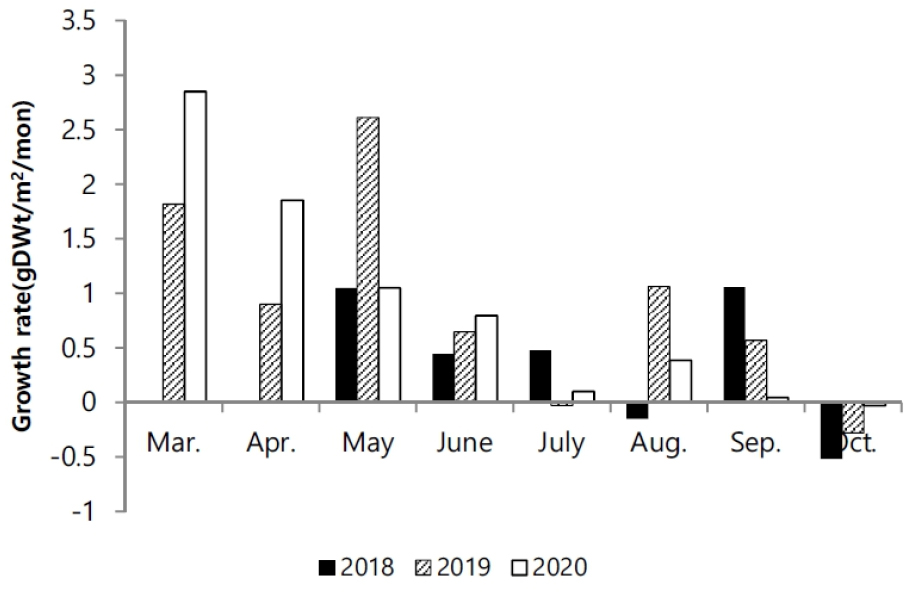
길이와 생체량의 생장에 대한 상관성은 시기마다 차이를 보였다. 2019년에 0.92로 다소 높은 상관성을 나타냈고, 2018년에 0.72으로 상대적으로 낮은 관련성을 나타냈다(Fig. 7). 2018년이 체장 생장에 비해 생체량의 비가 증가하는 양상을 보였다. 생장률은 발아이후, 5월까지 8월과 9월에 연도에 따라 높은 생장률을 나타냈다(Fig. 8). 연도별 생장률을 상이한 차이를 나타냈지만 초기 성장률이 높고 후반으로 갈수록 생장률이 감소했다.
2020년의 경우 3월의 생장률이 2.85 gDWt/m2/mon로 다른 시기에 비해 가장 높게 나타났고, 점차적으로 감소하였다. 2019년에는 5월까지 증가하다가, 감소하면서, 8월에 다시 증가하였고, 2018년에는 점차 감소하다가 9월이 가장 높은 생장률을 나타냈다(Fig. 8).
월별 생산량은 2월부터 5월까지 생산량이 서서히 증가한 후, 7월까지 감소하고 8월에 다시 증가하여 9월에 생산량이 가장 높았다(Table 2). 2018년에 518.99 gDWt/m2/yr로 연간 생산량이 가장 높았으며, 2019년 397.39 gDWt/m2/yr, 2020년 139.16 gDWt/m2/yr으로 감소했다. 3년간 평균 생산량은 351.85gDWt/m2/yr 으로 나타났다. 결과를 탄소량으로 환산하면, 월별 탄소량의 차이를 보였으며, 연간 탄소생산량은 143.41gC/m2/yr으로 추정하였다(Table 2).
Table 2.
Annual production calculated based on monthly growth rate
5. 고 찰
단년생 염생식물인 칠면초는 서해 조간대 상부에서 침수시간 8시간 이내 지역에 서식하는 종으로 갯벌의 함수량, 일조량 등 환경 조건에 따라 생장 차이를 보인다(류 2009; 이와 오 1989; 민 1998), 높은 염분농도에서도 80%이상의 발아율을 보이며(Yokoishi and Tanimoto 1994), 계절에 따라 발생할 수 있는 퇴적물의 염분 구획화를 통해서 갯벌 염분농도가 감소하는 이른 봄에 발아하여 다른 염생식물에 비해 발아시기가 빠르다(Li et al. 2011). 하지만 조간대 상부지역은 간출시간이 길고 육상으로부터 담수 유입이 상대적으로 원활할 수 있기 때문에 강수량에 영향을 받을 수 있고, 갯벌 표층에 일시적인 저염 공간이 나타날 수 있어서 원활한 수분 확보로 인해 빠른 발아가 진행되기도 하며(Lee and Ihm 2004), 저장된 종자에 많은 염분을 축적할 수 있어서 장기간 저염 상황에서도 생존 할 수 있다(Li et al. 2011). 퇴적물 환경, 수분, 서식밀도 등의 차이에 따라 잎의 함수량, 길이, 가지 수, 종자 수의 차이가 나타나기 때문에 동일한 서식조건에서도 해마다 변하는 환경 여건에 따라 생장 양상이 차이를 나타낸다(이와 오 1989). 3년 동안 동일지역에서 진행된 조사에서도 단년생 조건이 명확하였으며, 연간 생장과 탄소 생산량이 차이를 나타냈다.
서식 환경
서식 환경은 식물 생장에 복합적으로 작용한다. 염생식물은 조석과 염분 변화가 극심한 환경 조건을 가지고 있기 때문에 칠면초의 염분 스트레스 상황에서 발아 메커니즘(Yokoishi and Tanimoto 1994), 염분 상황에서 엽록체의 기능적 발달과 세포 생장 사이의 상관관계(Shizufumi et al. 1997), 칠면초의 색에 따른 항산화 활성에 관한 연구(Keisuke and Sakae 2010)도 진행되었다. 국내에서는 분포와 생육에 관련된 환경조건에 대한 연구가 수행되었다. 이번 연구에서 환경요인과 칠면초의 생장에 관한 상관분석과 교차상관분석에서 일조시간을 제외하고 강수량과 기온에서는 칠면초의 생장과 높은 상관관계를 나타냈다(Table 1). 기온와 서식밀도의 관계에서 기온이 먼저 선행된 후에 서식밀도가 따라간다는 것으로 해석할 수 있다. 결과에서 상관성이 적게 나타난 일조시간의 경우 식물이 생장하는데 가장 중요한 영향을 주는 항목이지만 일반적으로 일정한 수준을 나타내며, 장마기간에만 강수량에 영향을 받는다. 하지만 2018년 8월과 같이 비가 내린 일수가 11일 이내로 짧은 기간에 비가 온다면 일조시간에 영향을 주지 않기 때문에 일조시간의 변동성이 낮아진다(Fig. 2b). 따라서 생장과 낮은 상관관계를 나타낸 것으로 보인다. 하지만 주기적인 침수 등 환경 스트레스가 높은 칠면초의 경우 일조량에 의한 빛의 공급은 체내에서 betacyanin을 합성하여(Zhao et al. 2010), 체내 활성산소를 제거하고 세포의 산화적 손상을 막아주기 때문에(Keisuke and Sakae 2010) 칠면초 건강성 유지에 영향을 준다(Zhao et al. 2011). 따라서 환경 요소는 생장에 중요한 영향을 미치는 요인이기 때문에 일조시간뿐만 아니라 일조량에 대한 고찰이 요구된다.
발아조건
염생식물은 환경조건 중 강수량과 기온에 의해 생장 양상에 상이하다. 특히 기온은 초기 발아 조건에 중요한 인자이다(Andersen et al. 2020). 칠면초는 발아 잠재 시기인 1월, 2월경에 기온이 장시간 영하를 유지할 경우에 발아하지 못할 수 있다(Min 2005). 기온이 영하를 나타내면, 조간대 상부지역은 간출시간에 갯벌에서 결빙이 발생할 수 있어서 발아를 위한 생리적 변화에 영향을 주며, 심지어 결빙된 갯벌 표면이 밀물에 의한 물의 이동에서 일시 부유되면서 얕게 잠입된 종자가 동시에 밀려날 수도 있다. 이러한 양상은 발아 지역을 이동시킬 수 있어서 서식밀도에 영향을 미치기도 한다. 교차상관분석에서도 기온이 선행되었을 때 한달 차이에서 높은 상관관계를 나타냈다(Table 1). 3년간 월별 기후 변화를 비교했을 때 2018년 1월과 2월에 평균 기온이 영하권을 나타냈다(Fig. 2a). 1월의 경우 24일 동안 간출시 기온이 영하를 유지하였고, 2월은 20일 동안 영하를 기록하였다. 따라서 1,2월의 낮은 기온으로 인해 2018년 2,3월에 개체채집이 진행되지 못했다. 2018년에 비해 2019년과 2020년은 겨울철 온난한 날씨를 유지한 상황에서, 2월에 서식밀도는 상대적으로 적지만 발아가 진행되는 것을 관찰하였고, 3월부터 서식밀도가 증가하여 본격적으로 발아가 진행되어, 6월에 가장 큰 서식밀도를 나타냈다(Fig. 3). 6월까지 점차적으로 서식밀도가 증가한 것은 지속적인 발아율이 포함된 것으로 생각된다. 칠면초는 동시에 연속 발아하는 것으로 알려졌지만 3–6월까지 지속적인 발아가 진행되다가 7월 이후 급격하게 감소한다(Lee and Ihm 2004). 지속적인 발아로 인한 개체 증가는 5–6월까지 진행되고 있으며, 이번 조사에서 크기빈도 분포를 보면 새롭게 발아하는 개체는 2월부터 진행되면서 2019년에는 8월까지도 관찰되었다. 7월 이후 서식밀도가 감소한 것은 발아 개체가 적은 영향도 있지만, 장마로 인한 간출시 염분도 감소와 태풍 등 물리적 영향이 칠면초의 이탈을 원활하게 하는 등 사망률이 증가한 원인도 있다.
생장 양상
발아 시기는 연간 생장에 다양한 변화를 주었다. 2018년에는 3월 조사에서도 발아된 개체를 발견하지 못하였고, 4월에 비로소 전장이 6.0–8.9 cm에 이르는 개체가 다른 해와 유사한 서식밀도로 채집되었다(Fig. 6). 크기빈도 분포에 의하면 2018년이 다른 해에 비해 서식밀도는 낮았다. 4월에 다른 기간에 비해 많은 개체가 채집되었고, 6월부터 생장이 빠르게 진행되고, 7월 이후에 평균 체장이 가장 큰 개체가 출연하였다. 이런 양상을 고려하면, 2018년은 초기 발아가 늦게 진행되었고, 전반적으로 낮은 서식밀도를 나타냈지만, 7월 이후에 생장과 생체량 증가가 빠르게 진행되어 가장 높은 생산량을 나타냈다(Figs. 3 and 4). 2018년은 장마가 진행되는 7월과 국지적 대량 호우가 내리는 8월에 낮은 강수량을 나타냈으며, 9월에 높은 일조량으로 생장하기 원활한 환경조건을 갖춘 것으로 해석할 수 있다. 2020년 여름철에 100년만의 8월까지 이어지는 장기간 장마로 인해 상대적으로 높은 강수량을 나타냈고, 9월까지 이어지는 강수량 증가로 일조시간은 현저하게 감소하였다(Fig. 2). 서식밀도는 2019년과 유사하였지만, 생체량이 가장 증가하는 9월에 현저히 감소하여 생장률과 생산량이 가장 낮았다(Fig. 8, Table 2). 주요 생장시기인 8–9월 사이에 일조량 감소가 강수량 증가 보다도 월별 생장 비율에 영향을 미치는 것으로 추측된다. 실제로 월별 생장에서 2019년에 비해 주요생장 시기인 8–9월에 낮은 생장률을 나타냈다(Fig. 5). 길이 생장에서 지상부는 월별 완만한 생장을 보였지만 지하부의 경우 4–5월 사이에 빠른 생장을 보이고, 7월 이후에는 생장이 거의 이루어지지 않았다(Fig. 4). 염습지에 서식하는 종의 경우 정착시기 이전에 사망률이 높기 때문에 군락을 형성하는 데에 정착이 중요한 영향을 미치며, 뿌리 생장 속도가 종의 정착을 결정하는 요인이 된다(김 2013). 칠면초는 조수 영향을 많이 받는 위치에 서식하기 때문에 지속적인 물리 환경 변화에 대응하기 위해 초반에 뿌리가 먼저 생장하여 환경에 적응한 후 줄기가 생장하는 양상을 보인다(Lee and Ihm 2004). 이는 다른 종과의 경쟁에서 칠면초의 생존 전략으로 2월경 가장 먼저 출현하고 정착 하여 경쟁에서 우위를 정한다(Lee and Ihm 2004). 이러한 경쟁이 빠른 생장과 연관이 되었을 것으로 보인다. 김 (2013)의 결과에서 칠면초는 3월에 가장 높은 서식밀도를 보였고, 3–4월에 지하경이 먼저 생장한 양상을 나타냈다. 칠면초의 경쟁정도에 따라 생장 시기의 차이는 있지만 서식 양상은 유사하게 나타났다. 크기빈도 분포에서 초기 5월까지 개체들의 길이 생장이 유사하게 나타나다가 6월 이후 생장 차이를 보이며 분포 형태의 폭이 넓어졌다. 2018년의 경우 2019년과 2020년에 비해 발아시기가 늦어서 크기빈도분포가 정규분포 형태가 아닌 불규칙적인 경향을 보였으며, 7월까지는 다른 년도에 비해 길이 생장이 빠른 것을 확인했지만 결과적으로 9월부터 다른 해와 유사한 빈도분포를 나타냈다(Fig. 6). 이러한 결과는 생장속도에는 연도별로 차이가 있을 수 있지만 결과적으로 길이 생장에는 단년생으로 계절에 따른 생장의 한계가 있음을 보여준 것으로 해석할 수 있다.
생체량 변화 및 생장율
생체량은 길이 생장과 유사하게 지상경보다 지하경에서 먼저 생체량이 증가하였다. 지하경에서는 길이 생장과 생체량이 4월 이후 증가하였다. 지상경에서는 8월 이후 증가하였고, 연도에 따라 9월에 최대 증가를 나타내면서 9월 이후에는 급격히 감소하였다. 그러나 2020년에 8월 이후 급격하게 증가 양상을 보이지 않고, 지상경에서는 완만한 증가가 나타났고, 지하경에서는 오히려 급격히 감소하는 양상을 보였다(Fig. 5). 월별 생체량 변화는 공급되는 수분의 영향과 관련이 있는데(Leeuw et al. 1990), 2020년 8월의 높은 강수량이 영향을 주었을 것으로 보인다(Fig. 2b). 강수량이 많을 경우 지하수면(Water table) 상승을 야기하기 때문에 염분에 영향을 받으면서 생체량 증가에 영향을 받을 수 있다(Cui et al. 2008). 지하수면이 상승할 경우 토양 염분이 낮아지게 되며(Cui et al. 2008), 이러한 현상으로 칠면초 잎의 생체량이 감소하게 된다(Guan et al. 2011). Charles and Dukes (2009)에 따르면 군락을 형성하는 염생식물의 경우 강수량 증가로 인해 지상부 생체량이 감소하였다고 보고했다. 이러한 영향이 2020년에 8월 이후 다른 연도와 다르게 높은 강수량으로 인해 염분이 낮아진 상황에서 생존을 위해 염분 흡수를 하지 않아도 되기 때문으로 예상된다. 강수량이 많아질 경우 식물 생장에 가장 중요한 일조시간이 줄어들기 때문에 강수량으로 인해 생체량에 영향을 받았을 것이다. 생체량과 길이의 상관성 분석에서 2018년의 상관성이 낮은 이유는 같은 길이에서도 생체량이 상대적으로 높기 때문이다. 길이 생장에 비해 7월 이후 생체량이 증가한 것으로 길이 생장과 생체량 증가는 연도에 따라 차이를 나타냈다.
생산량 추정
월별 생체량 변화를 근거로 한 생장률은 조사 시기마다 다양하게 나타났다. 매년 월별 생장률은 발아 이후 증가하다가 점진적인 감소를 나타내고, 여름철 이후 일시적으로 증가하는 양상을 보였다(Fig. 8). 초기 생장률이 높은 것은 초기에는 낮은 생체량을 유지하기 때문에 생체량 증가에 대한 비중이 높아진다. 따라서 생장 후기에 비해 적은 증가에도 크게 영향을 받을 수 있기 때문에 초기 생장률이 높은 것으로 보인다. 생장 후기의 생체량 증가는 줄기의 생체량 증가에 많은 영향을 받은 것으로 판단된다. 지하부는 4월 이후 지속적으로 급격한 생장을 하기 때문에 초기와 다르지 않으나 지상부의 경우 후기에 급격한 생체량 변화를 보이기 때문에 생장 후기의 생장률에 영향을 주었을 것으로 판단된다. 또한 10월 생장 감소의 경우 칠면초는 10월에 생장보다는 잎의 탈락, 종자 이탈 등 생체량 감소요인이 증가한 것이 생장률에 영향을 주었을 것으로 예상된다. 연간 생산량 추정에서는 서식밀도가 가장 적었던 2018년이 가장 높은 생산량을 나타냈다. 반면에 2020년은 2018년의 30%정도에 미치는 생산량을 보였다(Table 2). 2020년은 발아 이후 빠른 생장을 나타냈으나, 생체량에서는 주요 증기시기인 9월 이후 급격히 감소한 것이 원인으로 보인다. 순수 탄소 생산량은 생체량에 비해 40%전후의 비중을 나타냈다. 가장 높은 생산량은 9월에 나타나며, 이후에 생체량과 유사하게 급격히 감소하는 양상을 보였다.