1. 서 론
2. 재료 및 방법
현장 조사 및 시료 분석
자료 분석
3. 결 과
해양 환경
중형동물플랑크톤 밀도, 생체량 및 우점종의 분포
중형동물플랑크톤 군집 분석
중형동물플랑크톤에 대한 환경 요인의 영향
4. 고 찰
5. 결 론
1. 서 론
동물플랑크톤은 운동 능력이 제한적이기 때문에, 이들의 출현 분포와 밀도는 수온(Rutherford et al. 1999; Rombouts et al. 2009)과 염분(Collins and Williams 1981; Cervetto et al. 1999), 수괴의 와류(Incze et al. 2001)나 용승(García-Reyes et al. 2014) 등 물리적 환경을 받으며, 현장의 먹이 농도와 포식압과 같은 생물학적 환경의 영향도 받는다(Taylor 1988; Sugimoto and Tadokoro 1997). 따라서 동물플랑크톤 군집을 이해하기 위해서는 해역에서 환경의 영향을 파악할 필요가 있다.
황해는 우리나라와 중국 사이에 위치한 평균 수심 44 m의 얕고 반 폐쇄적인 바다로, 육지에서 담수와 유기물 유입이 많고 계절에 따라 해황이 크게 변한다. 겨울철 계절풍이 있을 때에는 황해 난류(Yellow Sea Warm Current)가 저층에서 북쪽으로 흐르면서 따뜻하고 염분이 높은 물을 황해에 공급한다(Teague and Jacobs 2000; Lie et al. 2001; Xu et al. 2009). 여름철이 되면 황해 난류는 약화되고, 중앙부 저층에 수온 10°C 이하의 황해 저층 냉수괴(Yellow Sea Bottom Cold Water)가 형성되어 가을까지 유지된다(Zhang et al. 2008; Park et al. 2011).
황해에서 동물플랑크톤 출현량은 봄철에 식물플랑크톤 번성과 함께 증가하였다가, 수온 약층이 발달하는 여름철부터 감소한다(황과 최 1993). 황해는 수심이 얕아서 여름철이 되면 표층 수온이 크게 상승하는데, 이때 비교적 수심이 깊은 중앙부에 형성되는 황해 저층 냉수괴는 요각류 Calanus sinicus나 크릴 Euphausia pacifica와 같은 온대 종들이 표층의 고수온을 피해 여름철을 보낼 수 있는 대피처 역할을 한다(Wang and Zuo 2004).
본 연구는 황해 중동부에서 여름철 중형동물플랑크톤 군집 구조를 파악하고, 수온, 염분, 엽록소와 같은 환경 요인이 군집에 미치는 영향을 분석하고자 한다. 본 연구의 조사 정점은 우리나라 연안부터 황해 중앙부의 저층 냉수괴를 포함하기 때문에, 여름철 황해 중동부 중형동물플랑크톤의 광역 분포 특성을 이해하는데 기여할 것이다.
2. 재료 및 방법
현장 조사 및 시료 분석
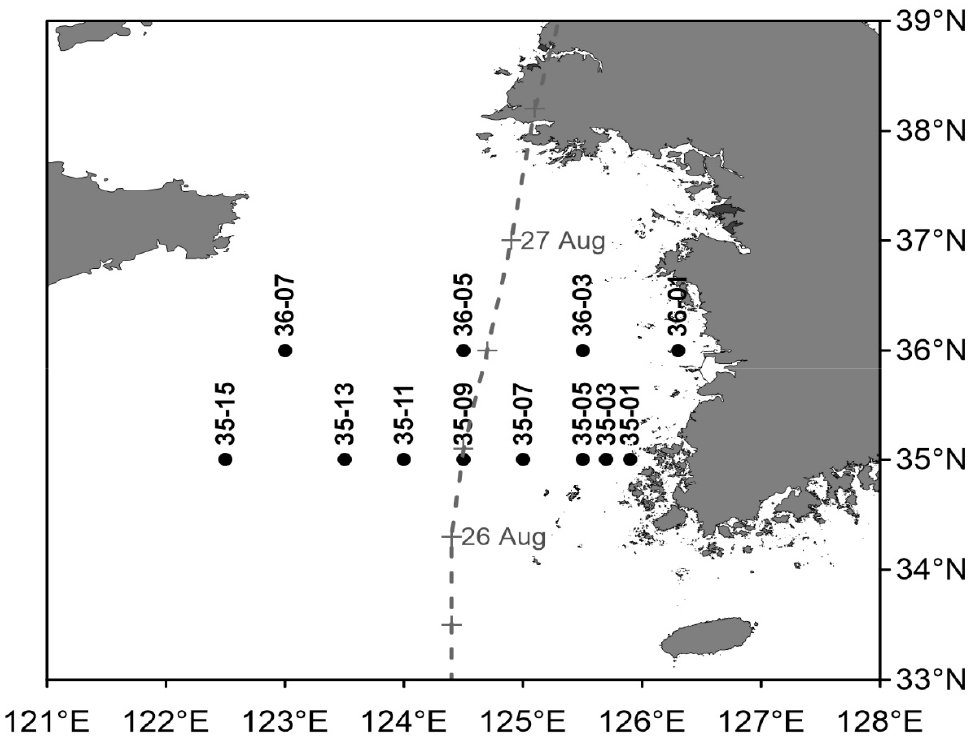
황해 중동부에서 2020년 8월 28일부터 31일까지 12개 정점에서 중형동물플랑크톤을 채집하였다(Fig. 1). 조사 직전인 8월 26–27일에 제 8호 태풍 바비(BAVI)가 중심기압 약 950 hPa, 초속 약 40 m/s로 조사 해역을 관통하였다. 조사 정점에서 입구에 유량계(Model 438-110, Hydro-bios, Germany)를 부착한 봉고네트(망구 60 cm, 망목 200 μm)를 저층부터 표층까지 복경사 예인(oblique tow) 하였고, 시료는 선상에서 5% 중성 포르말린으로 고정하였다. 실험실로 운반한 시료를 분할하여 최종 300–500 개체를 해부현미경(Stemi 2000-C, Zeiss, Germany)과 광학현미경(Axioskop, Zeiss, Germany)으로 종 동정 및 계수하였고, 네트를 통과한 유량(m3)으로 나누어 단위 부피당 개체수(밀도; ind. m-3)로 변환하였다.
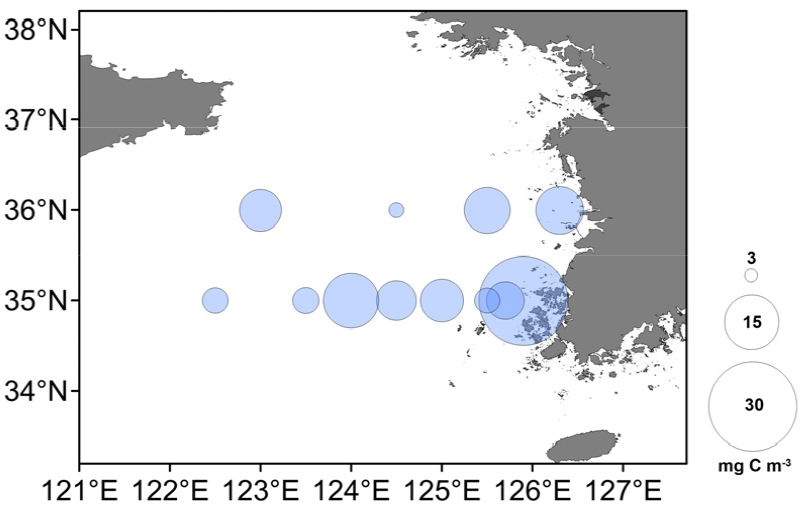
중형동물플랑크톤 생체량(Biomass)을 측정하기 위해 선상에서 시료를 GF/C여과지(Whatman, UK)에 여과하여 냉동 보관하였다가 실험실로 운반하였다. 시료를 60°C에서 24시간 건조하고 건중량을 측정한 후, 탄소량을 건중량의 45%로 가정하여 계산하였고(Ara 2001), 계산된 탄소량은 각 정점 별 유량(m3)으로 나누어 단위 부피당 탄소량(mg C m-3)으로 표현하였다.
조사 해역의 환경을 파악하기 위해 위와 동일한 12개 정점에서 엽록소-a (chl-a) 농도를 측정하였다. 층별 해수 500 mL를 GF/F 여과지(Whatman, Maidstone, UK)에 여과하여 냉동하였다가 엽록소를 추출하고 형광 광도계(10-AU, Turner Designs, USA)로 측정하였다. 중형동물플랑크톤 채집 정점을 포함한 22개의 조사 정점에서 수온과 염분을 CTD (Sea-Bird 911, Sea-Bird Scientific, USA)로 측정하였다.
자료 분석
중형동물플랑크톤 군집 분석은 전체 출현종의 밀도를 대상으로 Bray-Curtis의 유사도 거리 지수를 이용하여 집괴 분석(cluster analysis) 한 후, 그 결과를 60% 유사도 수준에서 nMDS (non-metric multidimensional scaling) 배열법으로 표현하였다. 집괴 분석으로 구분된 그룹을 대상으로 지표종 분석(indicator species analysis)을 하였으며, 지표 지수(indicator value)의 유의성을 Monte Carlo test로 검증하여 유의한(p < 0.05) 종만을 제시하였다. 집괴 분석과 지표종 분석에는 PC-ORD (ver. 7, MjM Software Design)를 이용하였다.
집괴 분석으로 구분된 두 그룹(A, B)에 대해 Shannon- Wiener의 종 다양도(H’)와 풍부도(richness)를 분석하여 비교하였고, 그룹 내에서 각 종들의 중요도를 평가하기 위해 SIMPER (similarity-percentages procedure)를 수행하였으며, 분석에는 PRIMER (version 6.1.6; Clarke and Warwick 2001)를 사용하였다.
전체 중형동물플랑크톤 밀도, 생체량, 상위 우점종 6종(Paracalanus parvus s.l., Oithona atlantica, Acartia omorii, Oikopleuridae, Sagittoidae juvenile, Calanus sinicus)의 밀도와 측정한 환경 요인(표층, 수층 평균, 저층 수온 및 염분, 표층과 수층 평균 chl-a 농도, 수심)사이에 상관 분석을 하였다. 밀도는 log10(x+1)로 변환하여 사용하였으며, 분석에는 SYSTAT 13(Systat Software Inc., USA)을 사용하였다.
3. 결 과
해양 환경
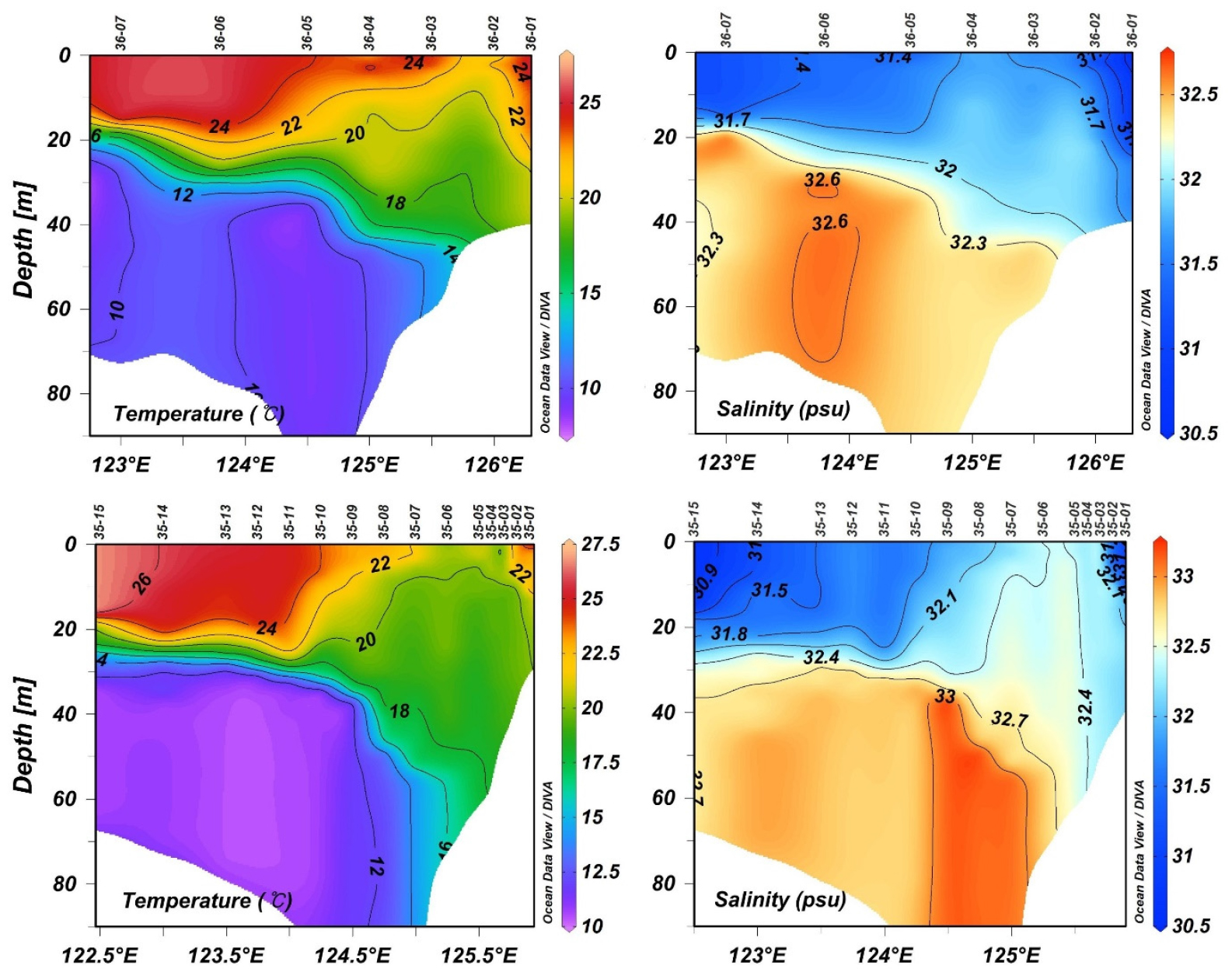
조사 해역의 수온은 정점 35-15의 표층(5 m)에서 26.7°C로 가장 높았고, 정점 36-05의 저층에서 9.1°C로 가장 낮았다(Fig. 2). 염분은 정점 35-09 저층에서 33.1 psu로 가장 높았고, 정점 35-15 표층에서 30.7 psu로 가장 낮았다. 35°N 황해 중앙골에서는 황해 난류의 흔적인 고염의 핵이 분포하였고, 36°N 중앙골에서는 황해 냉수괴의 특징인 저온의 핵이 분포하였다. 태풍의 오른쪽 반경인 연안역에서 등온선과 등염선 간격이 벌어졌는데(Fig. 2), 태풍에 의한 강한 연직 혼합이 있었던 것으로 보인다. 반면에 중간과 외해역 정점들의 수온 약층은 거의 간섭 받지 않아서, 태풍의 영향이 뚜렷하지는 않았다.
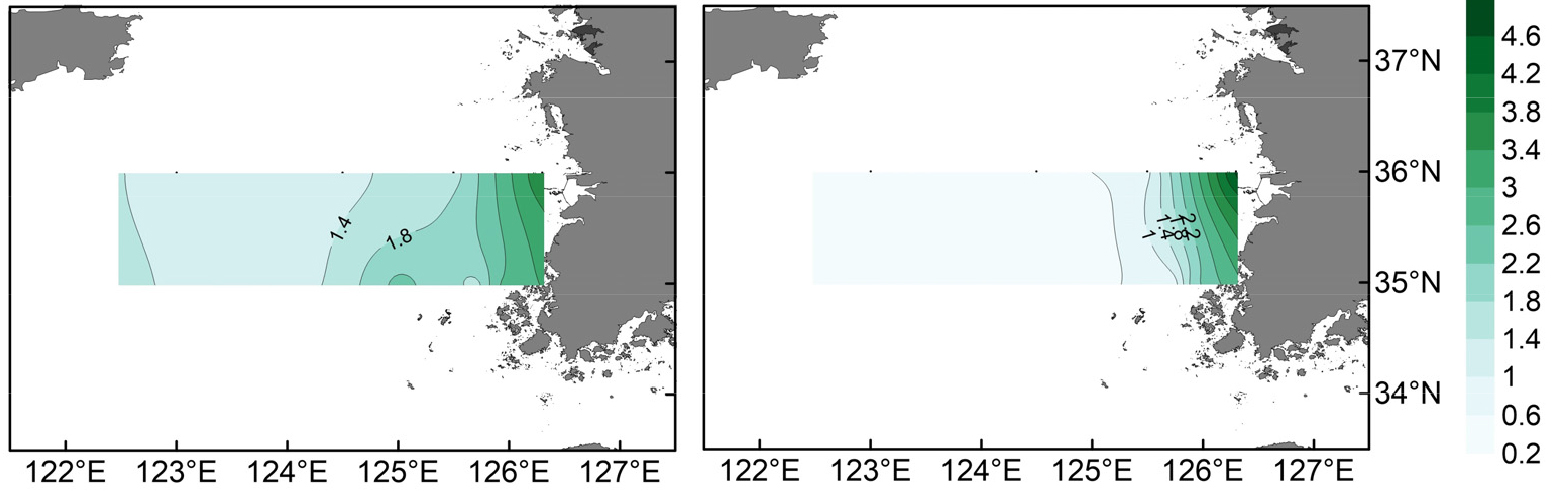
수층의 chl-a 농도는 표층(0 m)에서 0.1–2.8 μg L-1, 수층 평균이 0.3–4.8 μg L-1의 범위로, 표층과 수층 평균 모두 정점 36-01에서 가장 높고, 정점 35-11에서 가장 낮았다(Fig. 3). 표층과 수층 평균 모두 외해역보다 연안역에서 chl-a 농도가 높은 경향이 있었다.
중형동물플랑크톤 밀도, 생체량 및 우점종의 분포
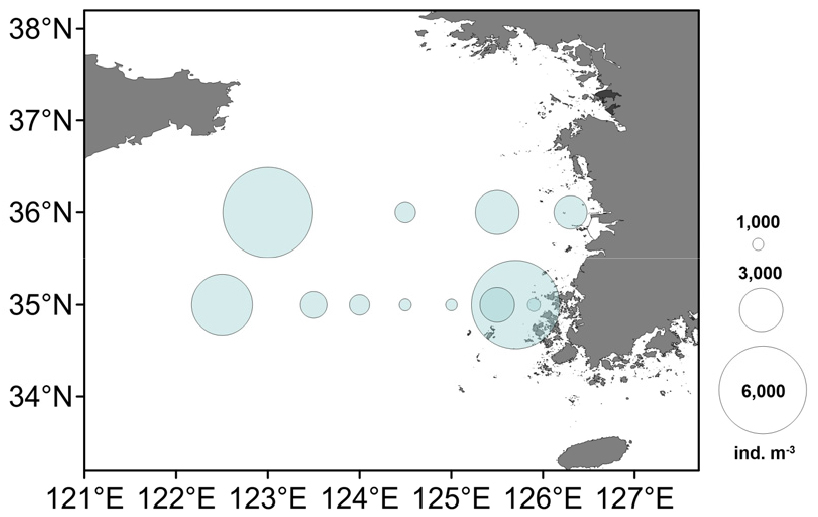
조사 해역에서 중형동물플랑크톤의 전체 밀도는 정점 별로 1,323–6,397 ind. m-3 범위로, 정점 36-07에서 가장 높았고, 정점 35-07에서 가장 낮았다(Fig. 4). 중형동물플랑크톤 생체량은 정점 별로 3.0–28.1 mg C m-3 범위로, 정점 35-01에서 가장 높았고, 정점 36-05에서 가장 낮았다(Fig. 5). 중형동물플랑크톤 전체 밀도는 연안역과 외해역에서 높고 중간 해역에서 낮았으며, 생체량은 연안역에서 비교적 높았다.
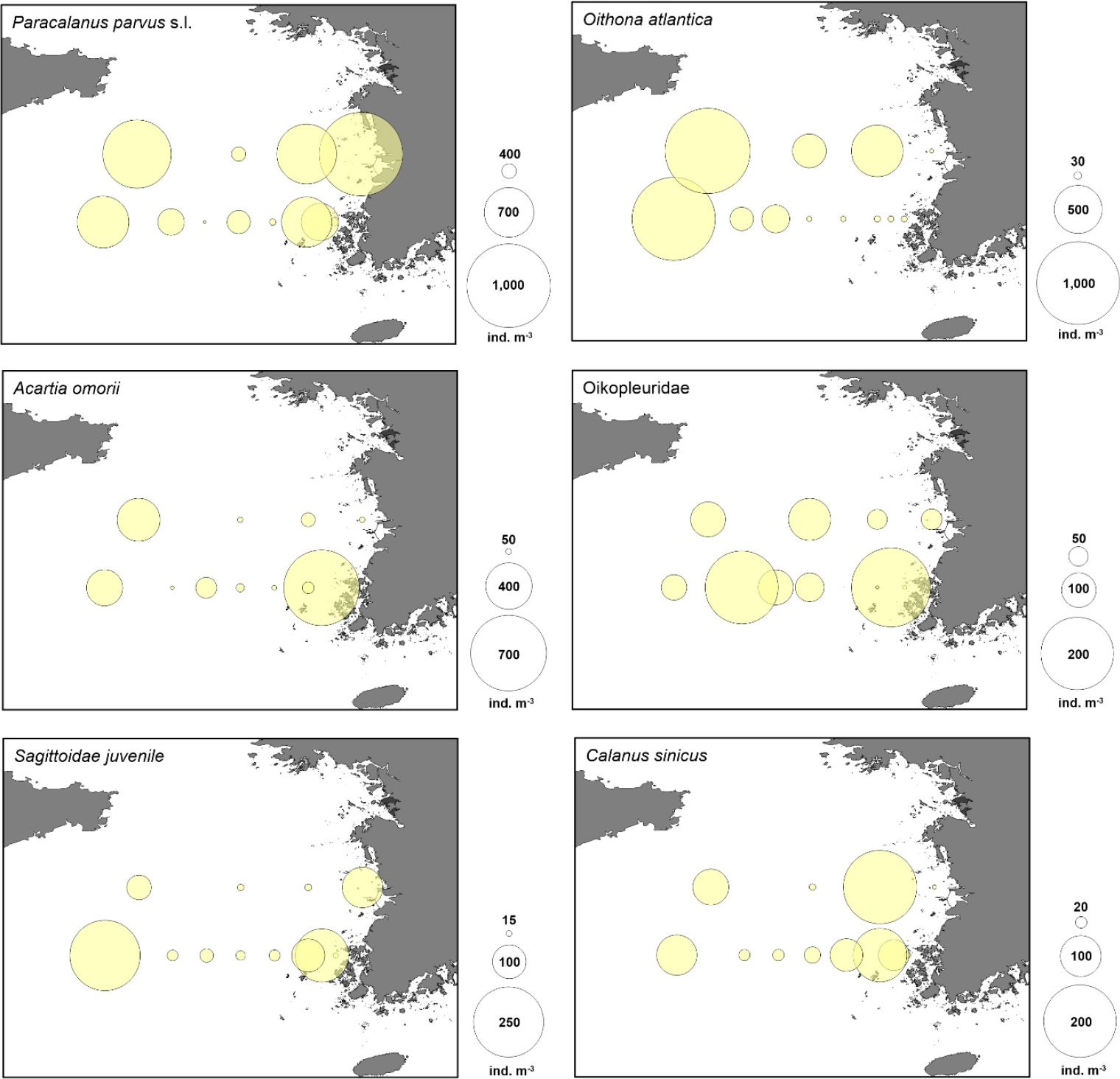
황해 조사 해역의 여름철 우점종 들은 요각류 Paracalanus parvus s.l., Oithona atlantica, Acartia omorii, 미충류(Oikopleuridae), 모악류 미성숙체(Sagittoidae juvenile), 요각류 Calanus sinicus였다. 이 중 Paracalanus parvus s.l., A. omorii, C. sinicus 및 Sagittoidae juvenile의 분포는 유사하였는데, 육지와 가까운 정점들과 바깥쪽에 위치한 정점들에서 많이 출현하였고, 그 중간 해역에서 상대적으로 적었다(Fig. 6). Oithona atlantica는 바깥쪽 외해 정점들에서 많이 출현하였고, Oikopleuridae는 35°N에서 비교적 많았다(Fig. 6).
중형동물플랑크톤 군집 분석
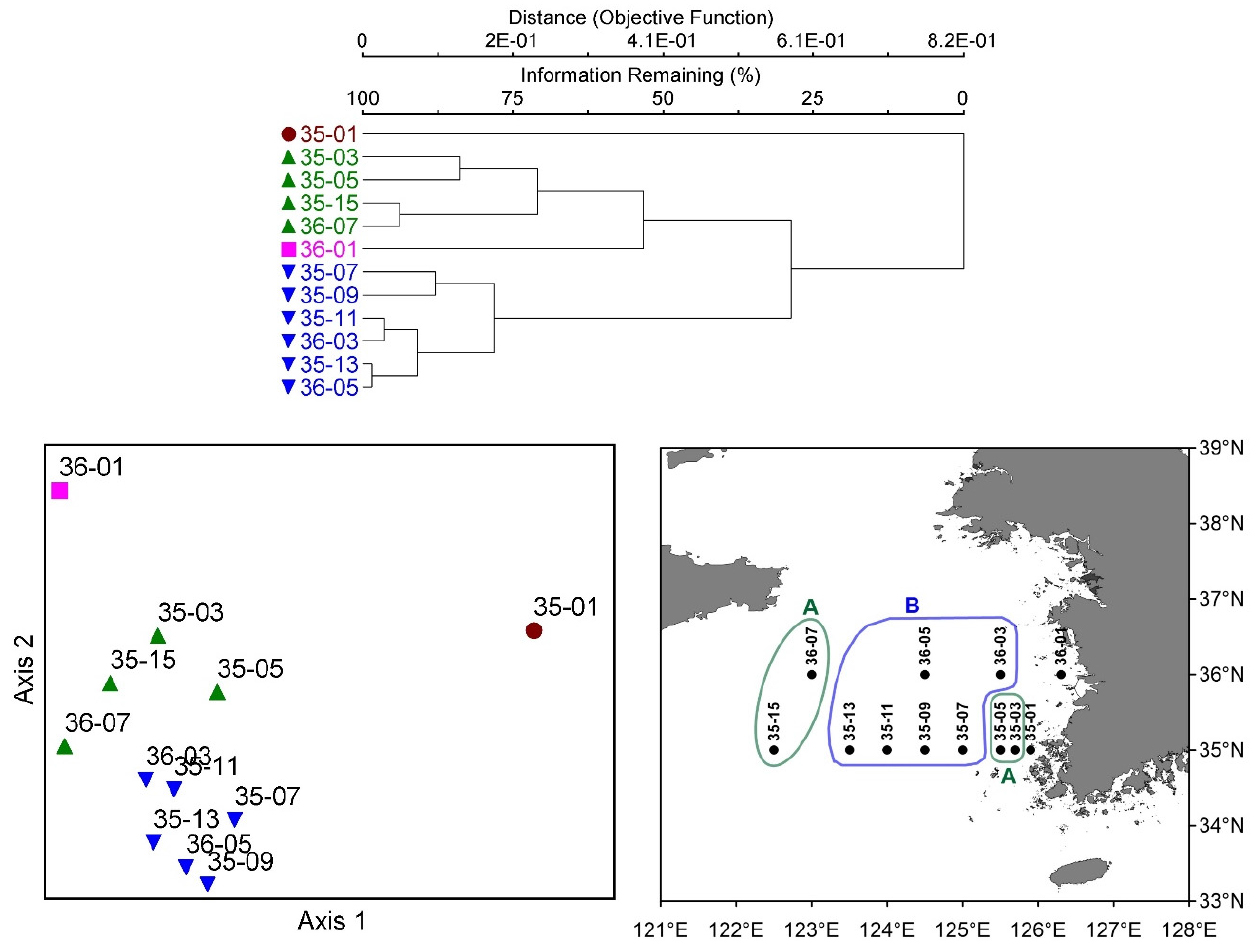
황해에서 여름철에 출현한 중형동물플랑크톤 군집은 출현 종과 밀도를 기준으로 두 개의 그룹으로 구분되었는데, 연안역에 위치한 35-03, 05와 외해역에 위치한 35-15, 36-07이 한 그룹(A), 중간 해역에 위치한 35-07, 09, 11, 13, 36-03, 05가 다른 한 그룹(B)이었으며, 육지와 가장 가까운 두 정점 35-01과 36-01은 그룹에 포함되지 않았다(Fig. 7).
그룹 A에서 중형동물플랑크톤 22종이 출현하여, 15종이 출현한 그룹 B보다 유의하게(p < 0.01) 출현 종 수가 많았다(Table 1). 밀도와 풍부도도 그룹 A가 그룹 B보다 유의하게(p < 0.05) 높아서, 황해 조사 해역의 연안역과 외해역이 중간 해역보다 다양한 종이 다수 출현하는 경향이 있었다. 두 그룹에서 기여도가 가장 높은 종은 요각류 Paracalanus parvus s.l.와 그 유생으로 동일 하였으나(Table 1), 그룹 A에서는 모악류 미성숙체의 기여도가 높은 반면, 그룹 B에서는 요각류 Oithona atlantica의 기여도가 높았다. 우점종들 중에서 P. parvus s.l., Sagittoidae juvenile, C. sinicus, Acartia copepodite의 밀도는 그룹 A에서 유의하게 높았다(t-test, p < 0.05).
Table 1.
Comparison of ecological parameters and dominant species (upper 60%) between the two cluster groups
군집 분석으로 구분된 두 그룹의 지표종 분석 결과, Oithona atlantica는 중간 해역에 위치한 그룹 B의 유일한 지표종 이었다(Table 2). 반면 그룹 A는 이매패류와 복족류 유생 등 여러 종이 지표종으로 분석되었으며, 극피동물 유생은 그룹 A에만 배타적으로 출현하는 지표종 이었다.
Table 2.
Indicator values of the two cluster groups with Monte Carlo test of significance (p < 0.05)
중형동물플랑크톤에 대한 환경 요인의 영향
전체 중형동물플랑크톤 밀도와 생체량은 측정된 어떤 환경 요인과도 유의한 상관 관계가 없었다(Table 3). 우점종 Paracalanus parvus s.l., Acartia omorii, Oikopleuridae, Sagittoidae juvenile 또한 환경 요인들과 유의한 상관 관계를 보이지 않았다. 요각류 Oithona atlantica는 수층 평균 및 저층 수온, chl-a 농도와 유의한 음의 상관 관계가 있었고, Calanus sinicus는 수층 평균 염분과 유의한 양의 상관 관계, 수층 평균 chl-a 농도와 유의한 음의 상관 관계가 있었다.
Table 3.
Results of correlation analyses between the density, biomass and dominant species of mesozooplankton and environmental factors (*p < 0.05, **p < 0.01)
4. 고 찰
황해 동물플랑크톤에 대한 이전 연구에서 여름철 우점종은 요각류 Calanus sinicus, Corycaeus affinis, Paracalanus parvus, Acartia 속 요각류(Acartia hongi, A. omorii, A. pacifica), Oithona 속 요각류(Oithona atlantica, O. plumifera, O. similis), 모악류(Sagitta crassa, S. enflata, S. nagae), 지각류(Penilia avirostris, Pseudevadne tergestina), 미충류 였다(황과 최 1993; Sun et al. 2010; Chen et al. 2011; Liu et al. 2012; Shi et al. 2020; Wang et al. 2021).황해 중서부의 이전 연구에서는 Calanus sinicus가 최우점 혹은 차우점한 반면, 황해 중동부의 본 연구에서는 Paracalanus parvus s.l.가 최우점 하였다(Fig. 6, Table 1). 황과 최(1993)의 연구에서도 여름철 황해 동부 연안에서 P. parvus s.l.가 우점한다고 보고되었다.
황해 중서부에서는 단각류 Themisto gaudichaudii (Liu et al. 2012; Wang et al. 2021)와 환근목 Doliolum denticulatum (Chen et al. 2011; Shi et al. 2020)이 우점종에 포함되었으나, 본 연구에서는 단각류 미성숙체가 소수(3.7 ind. m-3) 출현하였고, Doliolum은 출현하지 않았다. 환근목(Doliolids)은 원통형의 피낭동물로 대륙붕에 주로 분포하며 환경 조건에 따라 일시적으로 대번성을 일으킨다(Deibel 1985; Nakamura 1998). 황해 중서부 이전 연구에서 Doliolum이 다수 출현하였을 때 수온 범위는 17.9–29.7°C, 염분은 21.6–34.2 psu (Chen et al. 2011; Shi et al. 2020), chl-a 농도는 0.5–1.3 mg m-3으로(Shi et al. 2020), 본 연구의 수온, 염분, chl-a 농도는 Doliolum이 출현하기에 무리가 없었다. 다만, 황해에서 Doliolum denticulatum은 난류 지표종으로 보고되었기 때문에(황과 최 1993), 이 종의 출현 여부는 난류의 영향과 관련이 있을 수 있다.
황해 조사 해역에서 봄철과 가을철에 전체 중형동물플랑크톤의 밀도는 chl-a 농도와 유의한 양의 상관 관계가 있었다(김과 강 2019, 2020). 그러나 여름철 본 연구에서는 전체 중형동물플랑크톤 밀도와 수온, 염분, chl-a, 수심 모두와 유의한 상관 관계가 나타나지 않았다(Table 3). 봄철이나 가을철과 달리, 본 연구에서는 조사 해역의 중앙부에 위치한 그룹 B (Fig. 7)에서 중형동물플랑크톤의 밀도가 낮았다(Fig. 4). 그룹 B가 조사 직전에 태풍이 지나간 경로상에 위치한다는 점에서(Fig. 1), 태풍에 의해 동물플랑크톤이 주변 해역으로 밀려갔을 가능성이 있거나, 본 연구에서 조사되지 않은 환경 요인의 영향일 수 있으므로, 추후 여름철 추가 조사를 통한 검토가 필요하다.
온대종 요각류인 Calanus sinicus는 25°C 이상의 수온을 기피한다고 보고되었다(Uye 2000; Wang et al. 2003). 아산만에서 여름철에는 Calanus sinicus가 출현하지 않으며(박 등 1991; 명 등 1994), 황해에서는 표층의 고수온을 피해 황해 저층 냉수괴에서 여름을 보내는 것으로 알려져 있다(Wang et al. 2003). 그러나 본 연구에서는 C. sinicus가 황해 저층 냉수괴 보다 연안에서 더 높은 밀도로 출현하였다(Fig. 6). Wang et al. (2003)의 연구는 황해 중서부 중국 연안의 결과이기 때문에, 황해 전역에 걸친 김과 임 (1999)의 연구처럼 우리나라 연안에서는 여름철에도 C. sinicus가 다수 출현하는 것으로 판단된다. 다만, 본 연구 직전에 조사 해역을 통과한 태풍으로 인해 냉수괴의 C. sinicus가 연안으로 밀려왔을 가능성을 배제할 수는 없으며, 태풍의 영향이 없는 추가적인 여름철 조사가 필요하다.
5. 결 론
여름철 황해 중동부 조사 해역의 중형동물플랑크톤 군집은 연안과 외해 정점들이 한 그룹, 그 중간 정점들이 다른 한 그룹으로 구분되었다. 연안과 외해 그룹은 중간 그룹보다 중형동물플랑크톤 종이 다양하고 밀도가 높았다. 황해 중서부의 이전 연구와 달리, 조사 해역에서는 요각류 Paracalanus parvus s.l.가 최우점 하였다. 요각류 Calanus sinicus는 냉수괴 뿐 아니라 연안에도 다수 출현하였다. 여름철 본 연구에서 중형동물플랑크톤 밀도는 봄철, 가을철과 달리 chl-a 농도와 유의한 상관 관계가 없었다.