1. 서 론
용존유기물(Dissolved Organic Matter, DOM) 중에 빛을 흡수하는 유기성분을 유색용존유기물(Chromophoric Dissolved Organic Matter, CDOM)이라고 한다(Fig. 1). 조사된 빛 에너지를 효과적으로 흡수하여 들뜬 상태(excited state)가 된 CDOM은 높은 에너지 준위에서 에너지 양자를 방출하여 단 시간에 다시 안정적인 바닥 상태(ground state)로 돌아가면서 형광을 발생시키는데, 이러한 형광을 발하는 용존 상태의 유기물 성분을 형광용존유기물(Fluorescent Dissolved Organic Matter, FDOM)이라고 한다. FDOM이 빛을 흡수하고 방출할 때 나타나는 광학적 특성은 해수 중 용존 유기물의 분자구조에 따라 달라지게 된다. 유기물 분자구조는 생성 기작이나 기원에 따라 변하기 때문에, FDOM의 고유한 광학적 특성은 유기물의 기원과 특성을 파악할 수 있는 추적자(tracer)로 활용된다. 또한, CDOM과 FDOM의 농도는 해색(water color)과 투과도(light penetration) 등의 유광층 내 광질(spectral quality)에 영향을 주어 해양 생물의 성장에 영향을 준다. 이전의 연구 결과, 광합성에 영향을 주는 빛을 차단하여 일차 생산을 저해하기도 하고 해로운 자외선으로부터 연약한 미생물이나 치어가 보호되는데 중요한 역할을 한다고 알려져 있다.
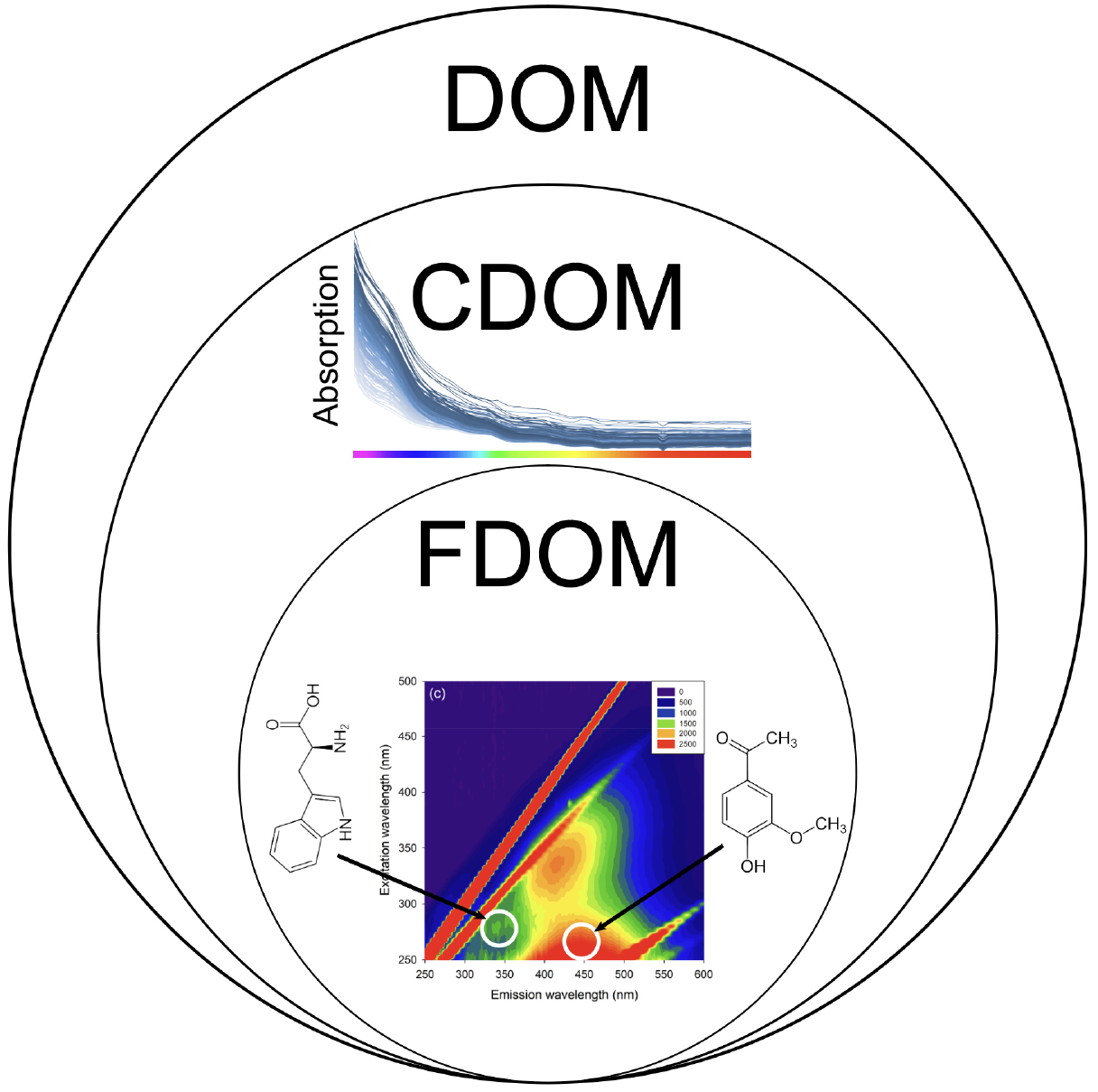
Fig. 1.
A schematic diagram of dissolved organic matter (DOM), chromophoric dissolved organic matter (CDOM), and fluorescent dissolved organic matter (FDOM). Examples of absorption spectra of CDOM and excitation-emission fluorescence matrices (EEM) of FDOM are shown over each domain. Skeletal formula of tryptophan amino acid (left) and vanillin (right) are represented on the EEM
일반적으로 FDOM은 휴믹상(humic-like)과 단백질상(protein-like) 형광성분으로 나뉜다. 휴믹상 형광성분은 휴믹산(humic acid)과 풀빅산(fulvic acid)의 최대 형광도가 나타나는 파장영역(가시광선과 장파장 자외선 영역)과 유사하기 때문에 휴믹상 피크라고 부른다(Coble 1996). 일반적으로 휴믹상 피크는 넓은 파장 범위(350~500 nm)의 형광 피크를 보이는데, 잘 알려지지 않은 다양한 유기물 성분들이 복합적으로 섞여 있기 때문에 넓은 파장에서 관측된다. 과거에 연안이나 하구역에서는 휴믹상의 형광성분의 농도가 너무 높아서 육안으로 황색을 띄게 되어, 이러한 형광용존유기물을 황색물질(yellow substance 또는 gelbstoff)이라고 일컬었다(Kalle 1938). 단백질상 형광성분은 상대적으로 짧은 파장의 가시광선 영역과 자외선 영역(300~350 nm)에서 관측되는데, 아미노산(amino acid)에서 발견되는 형광 파장과 유사하고 표층 해수 중 일차생산자의 발생과 함께 관측되었다(Coble 1996; Traganza 1969).
초기 광 분석 장치는 하나의 파장에서 광학적 세기를 측정하여 유기성분의 농도를 측정하였다. 이러한 방법은 현재 실시간 계측센서에서 여전히 활용되고 있는데, 특정 파장의 형광세기를 측정하여 DOM, 엽록소, 로다민(rhodamine)을 빠르게 계측할 수 있다. 실시간 광 센서는 시·공간적 연속성을 증가시켜 유기물 농도의 변동성이 큰 현상(태풍 등)을 이해하는데 이용되고(Saraceno et al. 2009; Spencer et al. 2007), 해수의 복잡한 수리학적 구조나 미세한 유기물 분포 특성을 관측하기 위해서도 이용된다(Yamashita et al. 2015). 형광 분석 기법과 자료 처리 기법이 고도화되고 일련의 연속적인 파장에서 형광도를 분석하게 되면서, FDOM은 유기물의 정량적인 농도뿐만 아니라 특성과 생성 기원에 관한 지시자로써 이용하게 되었다. 형광분광광도계(spectrofluorometer)는 연속적인 들뜸 파장(excitation wavelength)의 빛을 조사하여 시료에서 발생되는 연속적인 방출 파장(emission wavelength)의 형광 세기를 측정한다. 이러한 형광 신호는 일련의 3차원 들뜸-방출파장 행렬(Excitation-Emission Matrix, EEM) 형태로 자료가 생성되고, 형광 신호의 등고선도(contour plot)에서 관측되는 형광 피크의 분포를 통해 유기물의 특성과 기원을 알 수 있다.
국내 연구자에 의해서는 연안, 하구역, 대양, 극지방 등 다양한 환경에서 형광용존유기물의 특성이 연구되었다. 본 논문에서는 국내에서 실시된 형광용존유기물을 이용한 연구 동향을 간단히 소개하여, 유기물의 광학적 특성을 이용한 다양한 연구 가능성에 대하여 고찰해 보고자 하였다.
2. FDOM 성분의 광학적 특성
Coble (2007)과 Stedmon et al. (2003)은 다양한 환경에서 채취한 해수 시료를 분석하여 8가지의 대표적인 형광 피크를 선정하였다(Table 1). 널리 알려진 2가지의 단백질상 형광성분은 Coble (1996)에 의해서 B피크와 T피크로 불린다. B피크는 가장 짧은 파장(Exmax/Emmax = 275/310 nm)에서 형광 피크가 관측되는데, 타이로신(tyrosine) 아미노산과 유사한 형광 파장(Ex = 220~275 nm, Em = 300~305 nm)에서 발견되었다(Hudson et al. 2007). T피크는 B피크에 비해서 상대적으로 긴 파장(Exmax/Emmax = 275/340 nm)에서 형광 피크가 나타나는데, 트립토판(tryptophan) 아미노산과 유사한 파장범위(Ex = 220~275 nm, Em = 340~350 nm)에서 형광 피크가 발견되었다(Hudson et al. 2007). 이러한 최대 피크 파장에 대한 유사성을 바탕으로 B피크와 T피크를 프로틴상(protein-like) FDOM이라고 하고, 각각 타이로신 상(tyrosine-like)과 트립토판 상(tryptophan-like) FDOM이라고 세분하여 일컫는다. 일반적으로 단백질상 FDOM은 주로 플랑크톤에 의해 일차생산(primary production)이 활발한 해양의 표층과 퇴적물의 공극수에서 발견되었다(Yamashita and Tanoue 2003). 자연적인 생성 기작 뿐만 아니라 강으로 방류된 하수에서도 타이로신 상 FDOM의 특성이 발견되기도 한다(Hudson et al. 2007). 또한, Hernes et al. (2009)에 의하면 리그닌-페놀계 화합물(lignin phenols)을 추적하는데도 프로틴상 FDOM (특히 타이로신 상 FDOM)이 활용될 수 있음이 보고되었다. 따라서, 단백질상 FDOM은 해양의 일차생산과 연관된 비교적 최근에 생성된 용존 유기물과 연안 오염물질을 추적하는데 활용될 수 있다.
Table 1.
Commonly referenced peak and region locations for components of excitation-emission matrices (EEMs) obtained for aquatic humic substances and dissolved organic matter (aCoble 2007; bStedmon et al. 2003; cParlanti et al. 2000; dCoble et al. 1998)
주로 가시광선의 파장영역대에서 발견되는 형광피크는 크게 3가지로 나뉘는데, M피크(Exmax/Emmax = 312/380~420 nm), C피크(Exmax/Emmax = 350/420~480 nm), A피크(Exmax/ Emmax = 260/380~460 nm)이고 휴믹상(Humic-like) FDOM이라고 한다. 이러한 피크가 휴믹상 형광성분이라고 인식되는 이유는 휴믹산(humic acid)을 추출할 수 있는 합성수지(e.g., XAD)를 이용하여 추출한 해수에서 유사한 형광피크가 발견되었기 때문이다(Coble 1996). 단백질상 형광성분의 피크는 하나의 뾰족한 원뿔 모양을 보이는 반면에 휴믹상 형광성분의 피크는 둥근 곡선 모양의 피크가 넓은 파장영역대에서 발견된다. 이러한 휴믹상 FDOM의 피크 모양은 구성하는 유기성분이 개별로 규정하기 어렵고 다양한 기작과 기원에서 유래된 형광단(fluorophore)으로 구성된 유기 복합체이기 때문이다(Coble et al. 1990; De Souza Sierra et al. 1994). 일반적으로 휴믹상 유기물은 주로 육상 식물의 엽록소와 리그닌에서 생성된 방향족 탄소(aromatic carbon) 성분으로 구성되는데, 이러한 성분은 빛을 효과적으로 흡수하는 특징이 있다.
휴믹상 형광성분과 단백질상 형광성분은 구성하는 형광단의 크기가 서로 다른 것으로 알려져 있다. Baker et al. (2007)은 여과하지 않은 FDOM시료를 1.2 μm와 0.2 μm 공극 크기의 필터지를 이용하여 차례로 여과한 후 형광세기를 비교하였는데, 1.2 μm로 여과한 결과, 단백질상 형광세기는 -5% ~ -71% 감소하였고, 휴믹상 형광세기는 +2% ~ -22% 변하였다. 0.2 μm로 여과한 결과, 단백질상 형광세기는 -32% ~ -86% 감소하였고, 휴믹상 형광세기는 -4% ~ -30% 감소하였다. 이는 휴믹상 FDOM은 주로 콜로이드 크기의 유기물로 구성되어 있어서 필터의 공극 크기와 무관한 것으로 나타난 것으로 판단된다. 반면에, 단백질상 FDOM은 1.2 μm 이상 크기의 유기물로 판단된다. Kim and Kim (2015)은 0.2 μm와 0.7 μm 공극 크기의 필터로 여과한 후 휴믹상 형광성분과 단백질상 형광성분의 형광세기를 비교하였는데, 휴믹상 형광성분은 두 값이 거의 동일하게 나타났지만(r2 = 0.99), 단백질상 형광성분에서는 큰 분산이 관찰되었다(r2 = 0.64).
해수 시료의 EEM에는 시료 내 존재하는 형광용존유기물에서 발생된 광 신호 외에도 형광산란(scattering peak)이 발견된(Fig. 2)다. 형광산란은 레일리산란(Rayleigh scattering), 라만산란(Raman scattering), 틴들산란(Tyndall scattering)으로 구성된다. 레일리산란은 광원에서 조사된 빛에너지와 시료 내 물 분자 사이의 상호작용에 의해서 발생되는데, 들뜬 파장의 에너지와 동일한 에너지 형태로 에너지 교환이 없이 방출되므로 파장변화 없이 유지되는 탄성 산란(elastic scattering)의 특성을 보인다. 틴들산란은 시료 내 부유물질이 빛을 반사시켜 생기는 광 산란으로, 역시 들뜬 파장과 동일한 방출 파장에서 형광산란이 발견된다. 따라서, 레일리산란과 틴들산란은 EEM 그래프에서 1 대 1 대응하는 위치에서 형광산란 피크가 발견된다. 라만산란은 광원에서 조사된 빛 에너지와 물 분자사이의 상호작용에 의해서 생기는 광 산란인데, 레일리산란과는 다르게 일부 빛 에너지가 물 분자에 영향을 주어 에너지 손실이 발생하는 비탄성 산란(inelastic scattering)의 특성을 보인다. 따라서, 광원에서 조사된 빛의 파장에 비해서 긴 방출파장에서 형광산란이 발견된다. 이러한 산란의 형광세기는 일반적인 해수 중 유기물에서 기원한 형광세기에 비해 매우 강하기 때문에 유기물시료의 광학적 특성을 이해하는데 문제를 발생시킨다. 형광산란에 의한 간섭 효과를 제거하기 위해서 증류수의 EEM을 측정하여 제거하거나 형광산란이 위치한 곳의 자료를 삭제나 내삽(interpolation)하여 보정한다.
형광용존유기물 자료의 또 다른 간섭효과에는 내부흡수 효과(Inner Filter Effect, IFE)가 있다 (Xu et al. 2018). 측정할 시료의 유색용존유기물 농도가 지나치게 높을 경우, 광원에서 조사된 빛이 큐벳(cuvette) 내 모든 형광단과 반응하지 못하고 오직 광원과 인접한 외곽에 위치한 형광단만 반응하게 된다. 또한, 큐벳의 중앙에서 발생하는 형광이 분광계의 검출기로 이동하는 과정에서 주변 유색용존유기물에 의해서 재흡수되는 경우가 발생한다. 이러한 IFE로 인하여 형광 분광이 왜곡되거나 검출되는 농도가 감소하는 문제가 발생된다. IFE를 제거하기 위해서는 시료의 유기물 농도가 지나치게 높을 경우에 증류수로 희석해서 형광을 분석한다. 또한, 10 cm 폭의 큐벳 보다는 부피가 작은 1 cm 큐벳을 사용하여 빛이 간섭 받을 수 있는 확률을 낮추는 것을 추천한다.
3. FDOM 자료 처리 기법
형광산란은 자료를 해석하는데 있어 불필요한 정보를 지나치게 강조하고 통계처리 시 큰 편차를 발생시키기 때문에 증류수를 이용하여 물에서 발생되는 형광산란 신호를 제거할 필요가 있다. 하지만, FDOM의 농도가 매우 낮은 시료의 경우에는 이 과정에서 해수 중 시료의 형광신호에 영향을 준다. 이런 경우에는 3차원 보간법(interpolation)을 이용하여 형광산란을 제거하도록 한다(Zepp et al. 2004). 또한, IFE는 EEM의 들뜬/방출파장에서 흡광도를 측정하여 보정한다(Lakowicz 2013). 이 식은 형광단에 의한 형광파장이 큐벳의 정중앙에서 발생된다는 가정을 바탕으로 제시되었고, 비어-람베르트 법칙(Beer-Lambert’ Law)을 이용하여 보정방법을 사용한다(식 (1)).
FDOM 연구의 초기에는 하나의 들뜸-방출파장에서 측정되는 형광세기를 사용하여 유기물의 농도를 구하였다. 주로, Ex/Em = 370/460 nm에서 관측하였는데, Coble (1996)에 의해서 정의된 육상기원 휴믹성 형광성분(C peak)과 유사한 위치의 파장이다. 분석 장비의 발달로 인하여 연속적인 들뜸-방출파장에서 형광분광 분석이 가능해졌고, 각각의 들뜸-방출파장에서 측정한 형광세기를 3차원 행렬(EEM)로 나타낸 등고선도(contour) 형태로 FDOM의 자료를 나타낸다(Fig. 2). 이러한 형광 피크 위치와 패턴을 이용하여 FDOM의 기원과 특성을 파악하고, 특정 파장에서의 형광세기를 추출(peak-picking)하여 FDOM 농도를 측정한다(Table 1; Coble 2007; Stedmon et al. 2003). 기존의 단일파장에서 측정한 형광분석자료와는 다르게 3차원의 EEM을 바탕으로 다양한 형광성분의 혼합물인 시료를 분석하여 각각의 성분으로 나누어 구분할 수 있게 되었다.
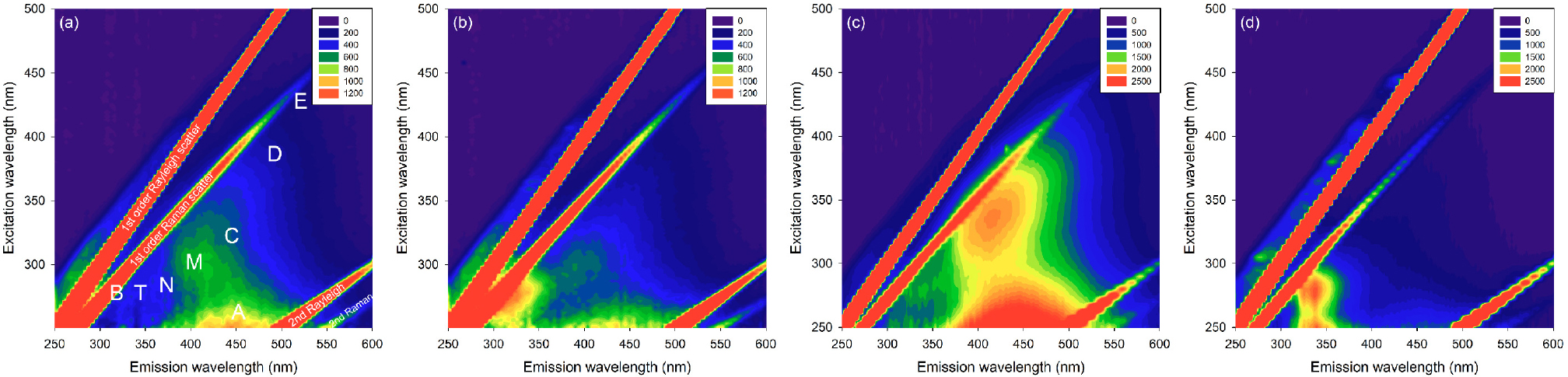
Fig. 2.
Representative examples of excitation and emission fluorescence matrices at (a) the deep water (Depth: 2220 m, Latitude: 37.00°N, Longitude: 131.33°E), (b) surface water (Depth: 2 m, Latitude: 37.00°N, Longitude: 130.00°E) in the East Sea, (c) the coastal groundwater of Sinyang Beach, and (d) drainage from a coastal aquaculture facility in Jeju Island. The locations of peaks described in Table 1 are shown in (a)
FDOM의 정량적비교를 위한 농도는 크게 두 가지 방법을 사용하여 표현한다. 첫번째는 1 ppb의 quinine sulfate dihydrate용액을 표준물질로 사용하여 1 ppb의 표준물질의 형광세기 대비 시료의 형광세기로 표현하며 Quinine Sulfate Equivalent units (QSE 또는 QSU)라고 표시한다. 또한, 최근에는 National Institute of Standards and Technology (NIST)에서 제공하는 표준물질(RM2941)을 사용하기도 한다. 하지만, 이러한 방법은 분광형광광도계의 광전증배관(phomultiplier tube) 전압(voltage)에 따라서 측정되는 형광세기가 매우 큰 차이가 나타날 수 있음이 보고되었다(Lawaetz and Stedmon 2009). 또한, 제조사마다 사용하는 계측기의 종류나 사양에 따라 반응하는 형광세기가 달라질 수 있기 때문에 다른 기기를 사용하는 연구자들 간의 농도비교가 어려울 수 있다. 최근에는 이러한 단점을 해소하기 위해 물의 라만산란 면적 대비 FDOM 성분의 형광세기로 표시하는 Raman Unit (RU)으로 나타낸다(Lawaetz and Stedmon 2009). RU를 이용한 방법은 측정 기기의 사양에 따른 형광세기 변화가 없고, 별도의 표준물질이 필요하지 않아 분석에 필요한 과정이 줄어들며 quinine sulfate 용액의 오염이나 변질에 대한 오차를 걱정하지 않아도 된다. 특히, 큐벳에 순수한 증류수를 담아 봉인하게 되면 새로운 증류수와 10년이 지난 증류수에서 측정되는 라만산란의 형광세기가 변함없이 일정하게 측정되어 분석의 일관성을 유지할 수 있다.
이후 통계적인 방법을 적용하여 다양한 유기물의 형광신호로부터 유의미한 형광성분을 추출하고자 하였다. 특히, PARAFAC (parallel factor analysis)은 3차원의 초기 형광 데이터세트를 삼중선형 항(trilinear term)과 잔차배열(residual array)로 분리하는 모형으로(식 (2)), 모식화된 형광성분들을 이용하여 초기 데이터세트를 최대한 구현하고 잔차를 최소하는 형광성분의 모양과 개수를 선정하여 고유한 형광성분을 추출하는 방식이다(Stedmon et al. 2003).
따라서, 모델에 입력된 데이터세트에 따라서 추출되는 형광성분의 모양과 개수는 변할 수 있다. PARAFAC모델을 통해 데이터세트로부터 추출된 형광성분은 그 연구해역, 조사시기, 환경특성에 따라 고유한 형태로 나타나기 때문에, 3차원 EEM에서 나타내는 형광피크처럼 모든 종류의 피크가 나타나지 않을 수 있다. 초기에 Stedmon et al. (2003)에 의해서 DOMFluor가 공개된 이후에 다양한 연구자들에 의해서 새로운 방식의 PARAFAC모델(e.g., PLS toolbox, Package eemR)이 다양한 프로그램(e.g., MATLAB, R)을 기반으로 공개되었다.
PARAFAC 모델을 통해 추출된 각 형광성분의 특성을 규명할 때, 일반적으로 Coble (1996)이 제시한 형광피크의 파장범위와 비교하여 형광성분에 대한 기원과 특성을 파악하였다(Table 1). 하지만, 이는 최대 형광이 나타나는 피크의 위치를 연구자의 판단에 따라서 선택하기 때문에, 유사한 형광성분을 정하는 과정에서 오류가 발생하거나 주관적인 견해에 영향을 받을 수 있다. 최근 Murphy et al. (2014) 가 구축한 OpenFluor (https://openfluor.lablicate. com/)는 개방형 데이터베이스로써, 연구자가 PARAFAC 모델로 구현한 형광성분의 파장 정보를 업로드하여 다른 연구자들이 기존에 생성한 모델 결과와의 통계적 유사도 제공해주는 브라우저이다. 분광파장의 유사도는 들뜸-방출파장의 Tucker의 적합계수(Tucker’s coefficient of congruence, θ)가 0.95를 모두 넘는 값을 기준으로 유사함을 규명하기 때문에 객관적인 비교를 통한 형광성분의 특성을 알려준다(식 (3)).
휴믹상 FDOM의 경우에는 다양한 기원과 성분의 혼합체이기 때문에 PARAFAC을 통해 얻은 형광성분의 갯수가 많을 경우에 복수의 PARAFAC 형광성분이 Coble (1996)에 의해 제시된 하나의 성분으로 중복되어 나타날 수 있다. OpenFluor를 통한 유사도 선정방식으로 구분하게 되면 개별 성분과 가장 유사한 이전 연구사례를 찾아 주기 때문에 보다 구체적인 FDOM의 거동 및 기원을 이해할 수 있다.
유기물 기원과 특성에 따라 형광 피크가 나타나는 EEM 상의 파장 정보를 바탕으로 특정 파장범위 내 두 형광세기의 비율을 이용하여 각 종 지수(index)를 계산하고 유기물 특성을 파악하는데 사용된다(Table 2). 부식화 지수(Humification Index, HIX)는 유기물의 부식화 정도를 나타내는 지표로 사용되는데, 유기물의 중축합(polycondensation)으로 고분자 화합물이 생성되면서 부식화 지수가 증가한다 (Kalbitz et al. 1999). 이는 추출된 휴믹산과 풀빅산의 HIX는 탄소/질소 비율(C/N ratio)과 유의미한 음의 상관성을 보이며 방향족 유기화합물의 C=C결합에 의한 1620 cm-1에서의 흡광 피크와 유의미한 양의 상관성으로 확인되었다(Kalbitz et al. 2000; 1999). 또한, Zsolnay et al. (1999)는 다른 피크의 범위에서 HIX를 계산하였는데, 부식화로 유기물의 수소/탄소 비율(H/C ratio)이 감소되는 사실을 발견하여 유기물의 부식화를 나타내는 지수로 사용하였다. 특히, 오븐 건조과정에서 유기물의 HIX 값이 감소됨을 보고하였고 건조효과로 인한 유기물 특성 변화를 제시하였다. Ohno (2002)는 고농도 유기물 분석 시, 흡광도 증가로 인한 단파장 영역대(300~345 nm)의 IFE가 증가하여 Zsolnay et al. (1999)의 방법으로 계산한 HIX 값이 증가함을 발견하였다. 254 nm 파장에서 흡광도가 0.3 cm-1 이상인 시료의 경우에 IFE에 따른 HIX 값 왜곡을 방지하기 위해서 새로운 HIX 값 계산 방법을 제시하였다(Ohno 2002) (Table 2).
Table 2.
Definition and calculation of indices derived from the excitation-emission fluorescence matrix. Awavelength is the peak area under the wavelength range; Iwavelength is the maximum fluorescence intensity within the wavelength range; ex and em indicate the excitation and emission wavelength, respectively
| Index (Abbr.) | Definition and information | Calculation | Reference |
|
Humification Index (HIX) |
Degree of humification with higher numbers indicative of lower H/C ratios shifting the emission to longer wavelengths | Zsolnay et al. (1999) | |
| Ohno (2002) | |||
|
Biological Index (BIX) | The proportion of recently produced DOM | Huguet et al. (2009) | |
|
Fluorescence Index (FI) |
Indicates if precursor material for DOM is of a more microbial (FI ~1.8) in nature or more terrestrially derived (FI ~1.2) | Cory and McKnight (2005) |
생물 지수(biological index, BIX)는 생물활동에 의해 비교적 최근에 생성된 유기물의 정도를 나타내는 지표로 사용된다. 연안환경에서 해수와 담수의 단성분(endmember) 시료의 FDOM 분석한 결과와 남조류(blue-green algae)를 이용한 실험실 분해 실험을 통하여 γ피크(B peak; Ex/Em = 270~280/300~320 nm)와 β피크(M peak; Ex/Em = 310~320/380~420 nm)가 생물 활동에 의해서 비교적 최근에 생성되는 것을 발견하였고, α피크(C peak)와의 형광세기 비율을 이용하여 생물지수(β/α비)로 활용하였다(Parlanti et al. 2000). 이후, Huguet et al. (2009)는 310 nm의 파장에서 조사하여 380 nm의 방출파장과 430 nm의 방출파장에서 나타나는 형광세기의 비율을 이용하여 생물지수(BIX)를 계산하였다(Table 2).
형광지수(fluorescence index, FI)는 육상식물과 퇴적물에서 기원한 유기물과 수층의 미생물 활동에 의해 생성된 유기물의 기원을 나타내는 지표로 사용된다. McKnight et al. (2001)의 연구결과에 따르면 육상식물 기원과 미생물 기원의 형광지수는 각각 약 1.4와 1.9의 값을 보였다. 특히, 육상 식물 기원의 유기물이 많은 미국의 호수와 강과 같은 담수환경(Suwannee River, Deer Creek, Snake River, Coal Creek)에서 추출한 풀빅산의 형광지수값은 1.3~1.4의 값을 보였고, 탄소 핵자기공명분광법(13C-NMR)을 이용한 방향성(aromaticity) 측정값은 25~30%로 나타났다. 반면에, 자가영양 미생물 기원의 유기물이 많이 생성되는 남극 호수(Lake Hoare, Lake Fryxell, Pony Lake)의 풀빅산은 방향성이 12~17%로 나타났고, 형광지수는 1.7~2.0의 값을 보였다. 이후에 Cory and McKnight (2005)는 사용하는 분석기기에 따른 형광지수값의 차이를 보정할 수 있는 새로운 형광지수를 보고하였는데, 370 nm의 파장에서 조사하여 470 nm의 방출파장과 520 nm의 방출파장에서 측정된 형광세기의 비율로 계산하였다(Table 2). 이러한 특성은 해수에부터 퇴적물 내 공극수 시료까지 매우 다양한 환경에서 획득한 시료를 서로 다른 실험실에서 분석하여 비교한 결과, 매우 유사함(r2 = 0.87)을 보였다 (Jaffé et al. 2008). 또한, Cory et al. (2007)는 광분해에 따른 형광지수의 변화가 거의 없음을 보여서 유기물 기원을 나타내는 추적자로써 활용 가능성을 제시하였다.
4. 국내 형광용존유기물 연구 사례
강으로부터 많은 양의 FDOM이 해양으로 공급된다고 알려져 있으며 이러한 육상기원의 FDOM 성분은 주로 염분과 음의 상관성을 보이게 된다. 육상에서 생성된 FDOM 성분은 육상의 동식물이나 퇴적층에 쌓인 저 분자량의 유기물이 중합(polymerization)과정을 거치면서 고 분자량의 유기물이 되는데 이때 광학적으로 형광특성을 띠게 된다. 우리나라 주변에는 양자강을 비롯한 많은 강으로부터 담수가 공급이 되고, 이 과정에서 FDOM이 해양으로 유입된다(Kim et al. 2018, 2020a; Kim and Kim 2015, 2020; Lee and Kim 2018; Lee et al. 2020). 특히, Lee and Kim (2018)은 낙동강 유역에서 월별 휴믹상 FDOM과 단백질상 FDOM의 변화를 염분과의 관계성을 이용하여 조사하였고, 강수량과 생물 생산성에 따른 FDOM 생성과 주변연안으로의 공급에 대한 중요성을 보고하였다. 우리나라 주변해역에는 세계에서 가장 큰 강 중의 하나인 양자강으로부터 많은 양의 강물과 다양한 육상기원 화학성분이 유입되며, 담수의 약 90%가 양자강에서 기원하는 것으로 알려져 있다. 동중국해, 황해, 남해, 동해에서 휴믹상 FDOM과 단백질상 FDOM은 염분과 음의 상관성이 관측되었는데 이는 양자강에서 기원한 FDOM이 보존적으로 주변 해수와 혼합되는 것으로 판단된다(Fig. 3; Kim et al. 2018). 하지만, Kim et al. (2020a)은 용존유기탄소(dissolved organic carbon, DOC)와 염분의 상관성에서 외삽법(extrapolation)으로 예측되는 양자강물의 DOC 농도(304±11 μM)가 실제 측정 농도(156±28 μM, Zhao and Gao (2019))에 비해 약 2배 높음을 발견하였고, 이는 미생물 기원 휴믹성 FDOM과 DOC 사이의 양의 상관성과 형광지수(FI, HIX, BIX) 값을 바탕으로 양자강희석수(Changjiang Diluted Water)가 생성되는 동중국해 해역에서 해양 미생물 대사작용(microbial metabolism)으로 추가로 DOC가 생성될 수 있음을 보고하였다.
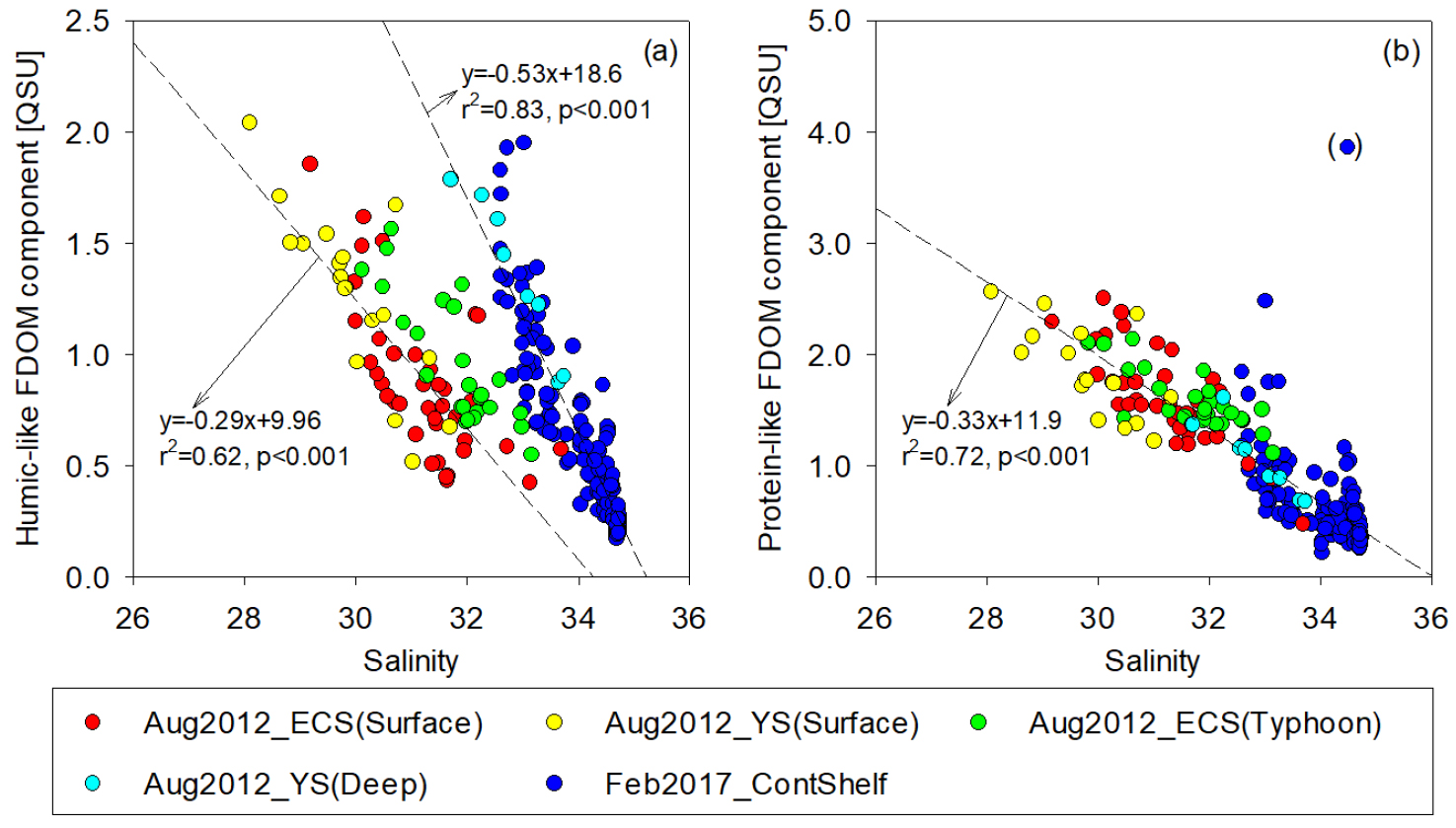
Fig. 3.
Scatterplots of the humic-like (a) and protein-like FDOM components (b) versus salinities in the continental shelf waters during August 2012 and February 2017 (Modified from Kim et al. (2018)). ECS, YS, ContShelf are the abbreviation for the East China Sea, Yellow Sea, and continental shelf area, respectively. The green circles represent the data obtained after a typhoon event
일반적으로 해양의 심층에서는 수심이 증가함에 따라 휴믹상 FDOM의 농도가 증가하는 분포를 보인다. 이러한 분포 특징은 해수 중 미생물의 활동에 의한 입자성 유기물의 분해 과정에서 휴믹상 FDOM이 생성된 결과로 알려져 있고, 심해의 겉보기산소소비량(Apparent Oxygen Utilization, AOU)과 휴믹상 FDOM 사이의 양의 상관성을 근거로 뒷받침 된다(Yamashita and Tanoue 2009). 우리나라 주변의 대륙붕 해역에서는 수심이 낮고 조석과 겨울철 밀도성층 약화로 인한 해수의 연직혼합 때문에 AOU와 휴믹상 FDOM 사이의 관계성이 발견되지 않지만, 동해에서는 이러한 특징이 잘 관측된다(Fig. 4). 일반적인 다른 대양에서는 AOU와 휴믹상 FDOM 사이에 하나의 직선적인 양의 관계성이 발견되지만(Jørgensen et al. 2011), 동해에서는 심층(200 m ~ 1000 m)과 저층(1000 m 수심 이상)사이에 AOU와 휴믹상 FDOM의 상관관계 기울기가 변한다고 보고되었다(Han et al. 2021a; Kim and Kim 2016; Tanaka et al. 2014). Tanaka et al. (2014)는 수심에 따른 AOU와 FDOM의 관계성 차이는 동해에서 침강하는 입자성 유기물의 분해도(lability)가 다른 대양과 다르기 때문인 것으로 추정하였다. Kim and Kim (2016)은 동해 심층(r2 = 0.82 & 0.66)에 비해서 저층(r2 = 0.10 & 0.31)에서 매우 낮은 AOU와 FDOM의 상관 관계성이 나타났기 때문에(Fig. 4), 무산소 기작에 의해 추가로 생성된 휴믹상 FDOM의 기원이 동해 심층에 존재하는 것으로 판단하였다. 또한, 해양 심층에서 표층으로 용승에 의해 공급되는 FDOM 기원은 해양 FDOM 순환연구에서 중요한 기작으로 인식되었으나 정량적인 중요성을 판단하기에는 어려움이 있었다(Nelson and Siegel 2002). 물질수지모델(mass balance model)을 적용하여 동해 심층에서 미생물 활동으로 생성된 휴믹상 FDOM이 동해 표층으로 공급되는 연직 플럭스를 계산하였고, 양자강으로부터 유입된 육상기원 플럭스의 약 20% ~ 30%를 차지하는 것으로 보고되었다(Kim and Kim 2015).
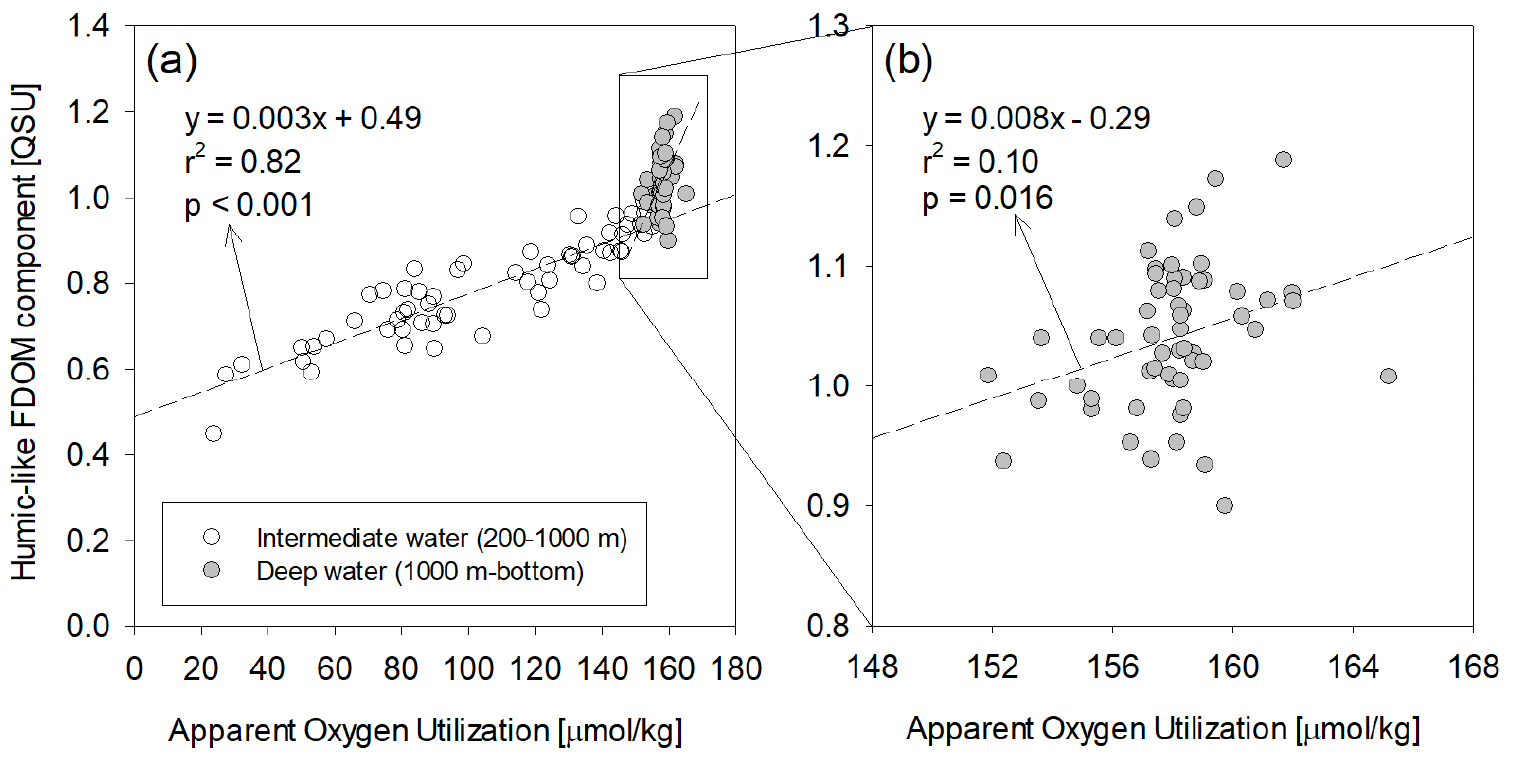
Fig. 4.
Scatterplots of the humic-like FDOM components versus apparent oxygen utilization in the intermediate water (a) and deep water (b) of the East Sea (Modified from Kim and Kim 2016)
일반적으로 연안환경에서는 다양한 FDOM 기원이 존재하는 것으로 알려져 있다. 하계 연안해수의 성층화 강화 및 연안 유기물 유입 증가로 인하여 해수 중 용존산소가 고갈 되는데, 시화호에서 용존산소 감소에 따른 휴믹상 FDOM이 증가되는 현상을 발견하였다(Kim and Kim 2020). 이러한 현상은 해수 중 용존산소 농도와의 비교 뿐만 아니라 퇴적층 내 무산소 기작의 지시자(indicator)인 암모니아와 인산염 농도와 비교, 낮은 산화 환원 전위(redox potential)의 값(60.0 mV)을 근거로 시화호 내 습지의 무산소 환경에서 생성되었음을 제시하였다(Kim and Kim 2020). 또한, 시화호에서는 FDOM을 추적자로 이용하여 계절에 따른 유기물 기원(난분해성, 생물기원, 퇴적물)을 보고하였고(Han et al. 2021b; Lee et al. 2017, 2014), 시화호 주변 연안환경을 산업구역(industrial area), 시골지역(rural area), 도시지역(urban area)으로 나누고 각각의 유기물 함량과 생물분해성(biodegradability) 등의 유기물 특성을 규명하였다(Lee et al. 2017).
제주도는 강수량이 많고 다공성 현무암질로 기반암이 구성되어 있기 때문에 많은 양의 육상 지하수가 해양으로 이동하고 지하수에 포함된 화학성분이 유입된다. 또한, 우리나라 주변 해역은 큰 조차로 인해 육상의 지하수가 해양으로 공급되는 것으로 보고되었다(Kim et al. 2015). 제주 북부의 조천만에서는 연안 용천수에서 나오는 담지하수가 휴믹상 FDOM의 주요한 기원으로 보고되었고 연안 해수 중 FDOM 양을 2 ~ 3배 증가시킨다고 예측되었다(Kim and Kim 2017). 제주 남서부의 화순만에서는 연안의 지하 하구(subterranean estuary)에서 휴믹상 FDOM이 염분과 음의 상관성을 보였는데, 담지하수와 해수가 혼합되는 지하 하구에서 휴믹상 FDOM이 보존적으로 거동하는 것으로 판단된다(Kim et al. 2013). Cho et al. (2021)는 태풍이 지나간 이후 제주도 화순 해수욕장에서 휴믹상 FDOM을 연안 담지하수의 추적자로 활용하여 해저지하수 유출량을 산정하고 연안해역으로의 영양염과 유기물의 플럭스를 산정하였다. 지하수관련 연구뿐만 아니라 제주 연안에는 350여개의 연안양식장이 거의 모든 연안선을 따라 운영 중인데, 양식장 배출수에 의한 연안 유기물 거동과 기원을 광학적 특성(흡광, 형광)과 주성분분석(principal component analysis)을 바탕으로 연구하였다(Kim et al. 2021).
국내 연구진들에 의해서 한반도 주변해역 뿐만 아니라 다른 대양에서도 활발히 연구가 진행 중이다. Kim et al. (2020b)은 인도양의 남북방향을 따라 FDOM 성분을 측정하였고 염분과 함께 끝 성분 혼합모델(endmember mixing model)에 적용하여 인도양 심층 수괴(water mass)를 구분하고 수괴간 혼합 비율을 계산하는데 활용하였다. Jeon et al. (2021)은 남극해에서 산소 동위원소(δ18O)와 FDOM 성분을 다변량 최적 분석법(optimum multiparameter analysis)에 적용하여 남극해 천수(meteoric water)와 남극 순환 심층수(circumpolar deep water)의 비율을 계산하였다.
5. 맺음말
이번 논문을 통하여 FDOM의 특성을 소개하고 국내 연구사례를 중심으로 해양환경 내 FDOM의 역할과 중요성에 대하여 살펴보았다. 광학적 분석법과 처리기법이 발전하면서 전 세계적으로 많은 연구가 진행되어왔고, 해양화학분야에 국한되지 않고 다학제간의 연구를 통해서 새로운 해양학적 현상에 대한 이해를 위해 활용되었다. FDOM을 이용한 이전 연구는 화학적 분석법(탄소·질소농도, 유기물 분자량, 안정동위원소비 등)과 비교하여 광특성을 이용한 FDOM의 기원과 특성에 관한 연구가 주를 이루지만, 최근 국제적인 연구 결과를 살펴보면 FDOM자료 분석을 위한 첨단기법 개발이나 기계학습법(machine learning technique)를 바탕으로 자기조직화지도(self-organizing map)를 활용한 새로운 시도가 진행되었다. 또한, 총 유기물 중에 FDOM이 차지하는 부분은 통상 20%~70%로 알려져 있으나, 정확한 정량적 정보가 거의 없는 매우 도전적인 연구로 해양탄소 순환의 연구분야에서도 중요할 것으로 판단된다. FDOM은 어느 유기물과 마찬가지로 해수 중 상태변화 과정에서 무기물(용존기체, 금속리간드, 영양염 등)과의 밀접한 연관성을 보이기 때문에 해수 중 용존물질의 생지화학적 거동에도 중요한 역할을 하는 것으로 알려져 있어 추후 매개체로써의 연구도 필요하다. 이번 논문을 통하여 국내의 많은 연구자들과 새로운 연구를 하고자 하는 학생들을 위해 FDOM에 대한 이해를 돕고 관련 연구가 활성화되기를 기대한다.




