1. 서 론
2. 재료 및 방법
현장조사 및 시료분석
자료분석
3. 결 과
해양환경
중형동물플랑크톤 밀도, 생체량 및 주요종의 분포
중형동물플랑크톤 군집분석
중형동물플랑크톤과 환경 요인의 관계
4. 고 찰
5. 결 론
1. 서 론
황해는 중국과 우리나라에 둘러싸인 해역으로, 주위에서 많은 담수가 유입되어 육지의 영향이 큰 바다이다. 또한 수심이 100 m 이하로 얕아 주변의 환경 변화에 따라 계절적으로 해황이 크게 바뀐다. 여름에는 장강저염수(Changjiang Diluted Water)의 영향이 있고, 중앙부에 형성된 황해저층냉수괴(Yellow Sea Cold Water Mass)가 가을까지 지속되며, 겨울에는 황해 난류(Yellow Sea Warm Current)의 영향이 강해지고 봄부터 이 난류가 북상하기 시작한다(Lie 1986; Park 1986; Lie et al. 2009).
동물플랑크톤의 분포와 출현은 수온(Rutherford et al. 1999; Rombouts et al. 2009)과 염분(Collins and Williams 1981; Cervetto et al. 1999), 수괴의 와류(Incze et al. 2001) 등다양한 환경 요인의 영향을 받기 때문에, 계절적 해황 변화에 따라 출현량도 변동한다. 황해는 봄철부터 동물플랑크톤 출현량이 증가하기 시작하여 6월까지 많다가, 다시 감소하여 여름에 가장 적어지는 계절적 변동을 보인다(황과 최 1993; 임 등 2003; 최와 박 2013).
황해의 동물플랑크톤 군집 구조의 경우 중국에 근접한 중서부에서는 난바다곤쟁이류와 모악류의 생체량이 많고, 요각류 Calanus sinicus가 황해 냉수괴 주변 해역에서 연중 우점한다(Sun et al. 2010; Chen et al. 2011; Liu et al. 2012). 그러나 우리나라에서 조사된 황해 중동부에서는 Paracalanus parvus s.l.이나 Acartia 같은 소형 요각류가 우점하고, 난바다곤쟁이나 모악류의 비중은 낮았다(심 등 1988; 황과 최 1993; 국토해양부 2009). 우리나라에서 황해 광역의 동물플랑크톤 군집 연구는 다수 발표되었으나(Shim and Park 1982; 심 등 1988; 유 1991; 박 등 1992; 황과 최 1993; 장과 김 1998; Kang and Kim 2008; 임 등 2009), 대부분은 종 조성을 보여주며, 환경의 영향에 대한 고찰은 매우 제한적이다.
이 연구는 황해 광역에서 중형동물플랑크톤 출현량이 증가하는 봄철에 중형동물플랑크톤 군집 구조를 파악하고, 수온, 염분, chlorophyll-a (chl-a)와 같은 환경이 군집에 미치는 영향을 분석하고자 한다.
2. 재료 및 방법
현장조사 및 시료분석
2019년 4월 20일부터 24일까지 황해의 16개 조사 정점에서 중형동물플랑크톤을 채집하였다(Fig. 1). 봉고네트(망구 60 cm, 망목 200 μm)의 입구에 유량계(Model 438-115, Hydro-bios, Germany)를 부착하여 저층부터 표층까지 복경사 예인(oblique tow) 하였고, 채집된 시료는 선상에서 5% 중성 포르말린으로 고정하였다. 실험실로 운반한 시료를 분할하여 최종 300–500 개체를 해부현미경(Stemi 2000-C, Zeiss, Germany)과 광학현미경(Axioskop, Zeiss, Germany)으로 종 동정 및 계수하였고, 네트를 통과한 유량으로 나누어 단위 부피당 개체수(밀도; ind. m-3)로 변환하였다.
조사 해역의 환경을 파악하기 위해 중형동물플랑크톤 채집 정점을 포함한 28개의 조사 정점에서 수온과 염분을 CTD (Sea-Bird 911, Sea-Bird Scientific, USA)로 측정하였다. 또한 chl-a 농도를 측정하였는데, 층별 해수 500 mL를 GF/F 여과지(Whatman, UK)에 여과하여 냉동하였다가 엽록소를 추출하고 형광광도계(10-AU, Turner Designs, USA)로 측정하였다.
중형동물플랑크톤의 생체량을 측정하기 위해, 선상에서 고정되지 않은 시료를미리 무게를 측정한 GF/C여과지(Whatman, UK)에 여과하여 냉동 보관하였다. 실험실로 운반한 시료는 60°C에서 24시간 건조시키고 건중량을 측정한 후, 생체량(탄소량)을 건중량의 45%로 가정하여 계산하였고(Ara 2001), 계산된 탄소량은 각 정점별 유량(m3)으로 나누어 단위 부피당 탄소량(mg C m-3)으로 표현하였다.
자료분석
중형동물플랑크톤 종 다양성 분석에는 Shannon-Wiener 종 다양성 지수(H’)를 사용하였다. 군집분석은 전체 출현 종의 밀도를 대상으로 Bray-Curtis의유사도 거리 지수를 이용하여 집괴분석(cluster analysis)을 한 후, 그 결과를 60% 유사도 수준에서 Non-metric multidimensional scaling (nMDS) 배열법으로 표현하였으며, 분석에는 PRIMER (version 6.1.6; Clarke and Warwick 2001)를 이용하였다. 집괴분석으로 구분된 그룹을 대상으로 지표종 분석(indicator species analysis)을 하였으며, 지표 지수(indicator value)의 유의성을 Monte Carlo test로 검증하여 유의한(p < 0.05) 종만을 제시하였다. 지표종 분석에는 PC-ORD (version 7, MjM Software Design)를 이용하였다.
중형동물플랑크톤의 밀도에 환경 요인이 미치는 영향을 이해하기 위하여, 전체 밀도의 1% 이상을 차지하는 출현 종 12종(Acartia hongi, A. omorii, Calanus sinicus, Centropages abdominalis, Ditrichocorycaeus affinis, Oithona atlantica, O. similis, Paracalanus parvus s.l., Euphausiid eggs, nauplius, calyptopis, Oikopleuridae)과 환경 요인(5 m 수심과 수층 평균의 수온과 염분, 0 m 표층과 수층 평균의 chl-a)사이에 중복 분석(redundancy analysis)을 시행하였다. 분석은 CANOCO (version 5.0; ter Braak and Šmilauer 2012)를 사용하였다. 추가적으로 상위 우점종 요각류를 대상으로 Pearson 상관분석을 시행하였고, 분석에는 SYSTAT 13 (Systat Software Inc., USA)을 사용하였다. 중복분석과 상관분석에서 중형동물플랑크톤 밀도는 loge (x+1)로 변환하였다.
3. 결 과
해양환경
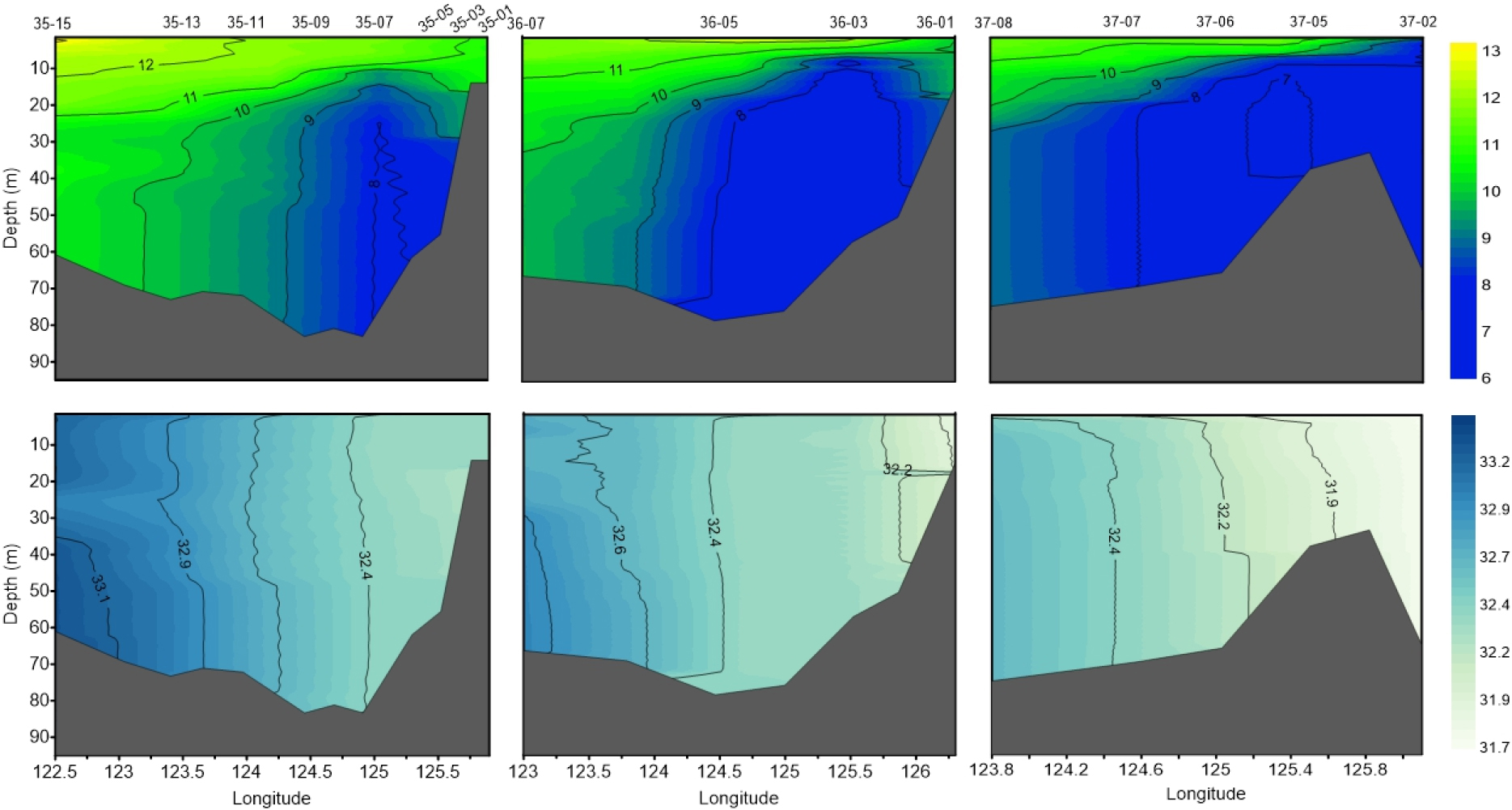
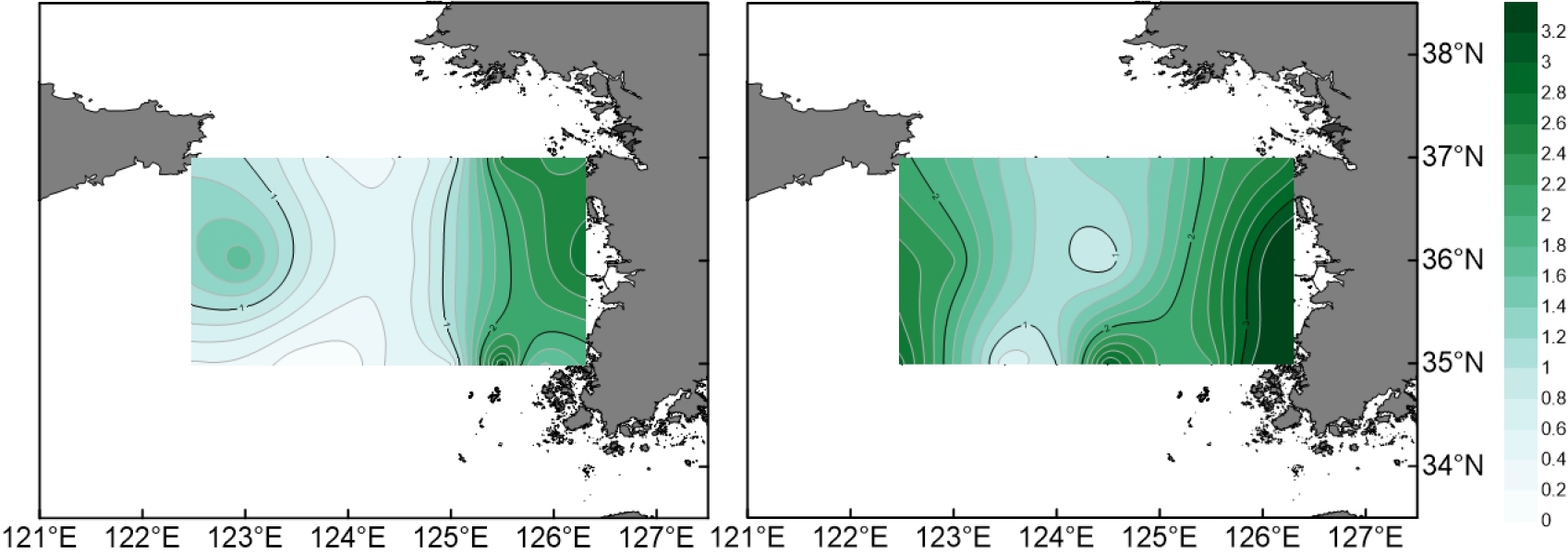
4월 황해 조사 해역의 수온과 염분의 수직분포를 보면, 수온은 정점 35-15의 표층에서 13.1°C로 가장 높았고, 정점 37-05의 저층에서 6.7°C로 가장 낮았다(Fig. 2). 염분은 정점 35-15의 저층에서 33.3 psu로 가장 높았고, 정점 37-02의 표층에서 31.7 psu로 가장 낮았다. 연안은 상대적으로 저온, 저염인 반면 외해는 고온, 고염이었고, 가장 외해에 위치한 정점에서 황해 난류의 영향을 볼 수 있었다. 조사 해역의 동쪽 저층에 저온수가 관찰되었고, 염분의 연직 분포는 균질 하였다. 수층의 chl-a 농도는 표층에서 0.1–3.1 μg L-1, 수층 평균 0.7–3.8 μg L-1의 범위로, 표층과 수층 평균 모두 정점 35-13에서 가장 낮았고, 표층은 정점 35-05에서, 수층 평균은 정점 36-01에서 가장 높았다(Fig. 3). chl-a 농도는 대체로 육지와 가까운 정점들에서 높았다.
중형동물플랑크톤 밀도, 생체량 및 주요종의 분포
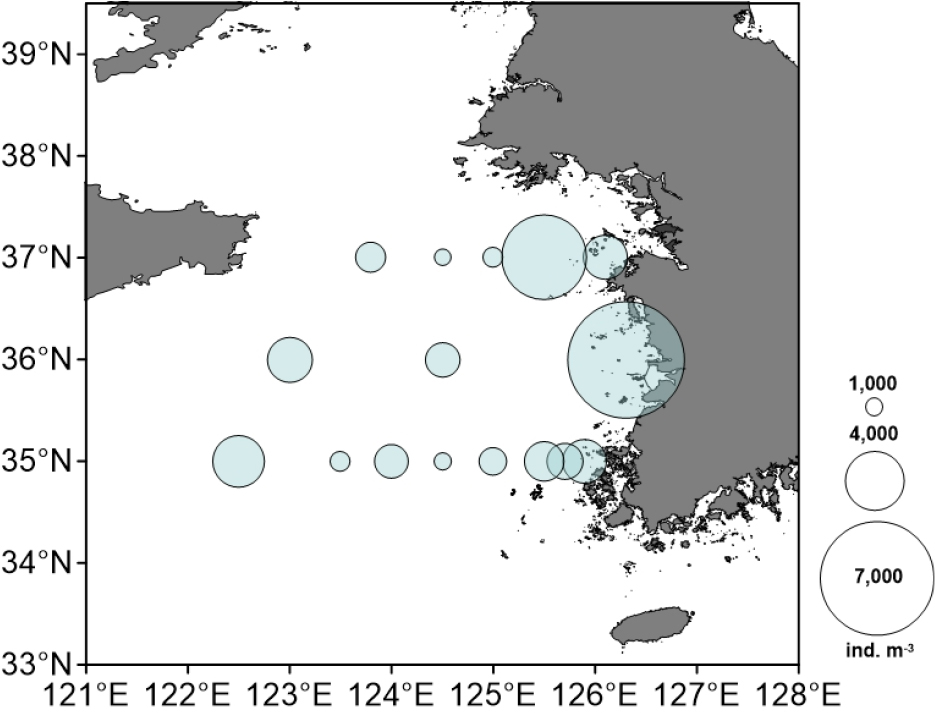
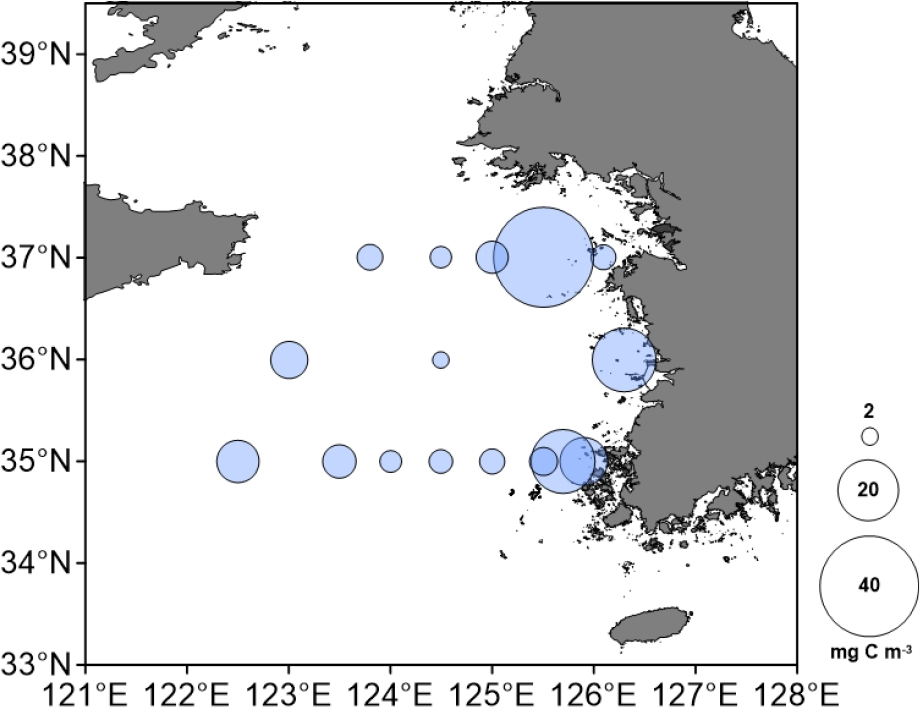
황해 조사 해역에서 전체 중형동물플랑크톤 밀도는 1,542–7,367 ind. m-3 범위로, 정점 36-01에서 가장 높았고, 정점 37-07에서 가장 낮았다(Fig. 4). 분류군의 대부분은 요각류로서, 전체 밀도의 57.6–98.8%를 차지하였다. 경도 125.5도를 기준으로 육지와 가까운 안쪽 정점들에서 중형동물플랑크톤 밀도가 비교적 높았다. 중형동물플랑크톤 생체량의 경우 정점별로 2.6–41.9 mg C m-3 범위로, 정점 37-05에서 가장 높았고, 정점 36-05에서 가장 낮았다(Fig. 5). 생체량 또한 밀도 분포와 마찬가지로 육지와 가까운 정점들에서 비교적 높았다.
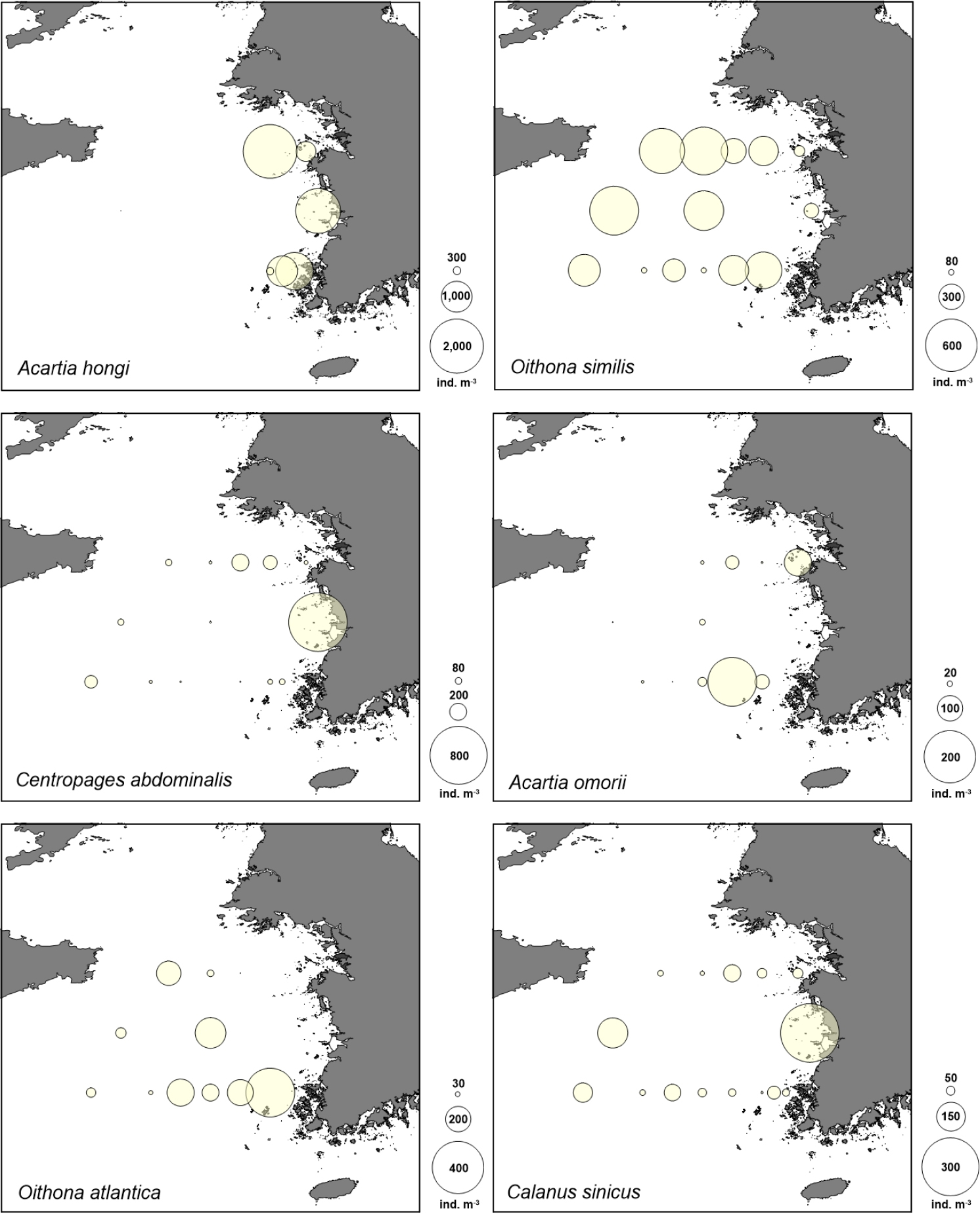
출현 종들 중에서는 요각류 Acartia hongi, Oithona similis, Centropages abdominalis, A. omorii, O. atlantica와 그 유생 및 난바다곤쟁이의 알과 유생이 군집에서 우점하였다(Table 1). Acartia hongi의 분포는 연안 정점들에 집중되어 외해에는 출현하지 않았고, O. similis는 전 정점에 고루 출현하였다(Fig. 6). Acartia omorii는 중간 해역에 분포하였고, 밀도는 정점 35-07에서 가장 높았다. Oithona atlantica는 연안 정점들에 거의 출현하지 않았고, Centropages abdominalis는 전 정점에 고루 출현하되 36-01 정점에서 특히 많았다. 상위 우점종은 아니지만 황해에서 중요한 종인 요각류 Calanus sinicus도 전 정점에 고루 출현하였으며, 정점 36-01에서 밀도가 높았다.
Table 1.
Mesozooplankton species that contributed more than 1% to the total density
중형동물플랑크톤 군집분석
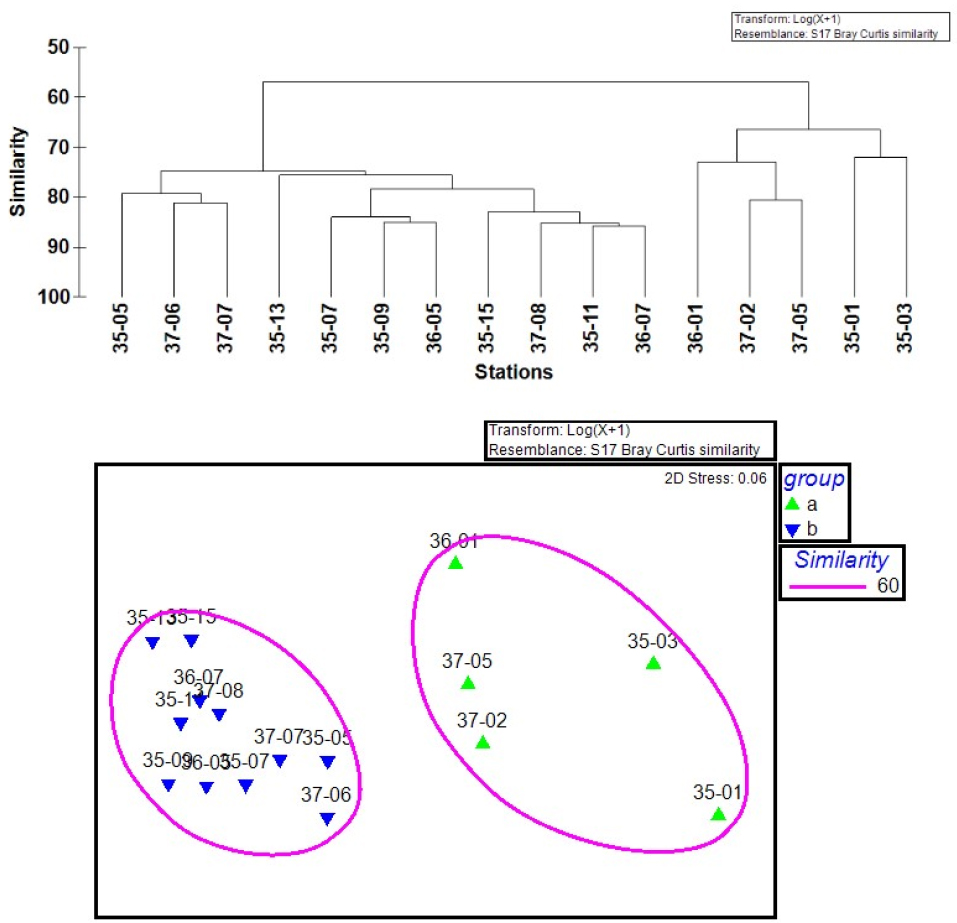
황해 조사 해역의 중형동물플랑크톤 군집은 출현 종과 밀도를 기준으로 두 개의 그룹으로 구분되었는데, 육지와 가까운 연안에 위치한 35-01, 03, 36-01, 37-02, 05 정점이 한 그룹, 외해에 위치한 나머지 정점들이 다른 한 그룹이었다(Fig. 7). 중형동물플랑크톤 종 다양성과 분류군 수는 외해 그룹에서 각각 평균 2.47과 약 22개로 연안 그룹의 1.75와 약 16개 보다 유의하게 많았으나(p < 0.01; t-test), 전체 밀도와 생체량은 연안 그룹에서 평균 4,364 ind. m-3와 23.1 mg C m-3으로, 외해 그룹의 2,351 ind. m-3와 8.0 mg C m-3보다 높았다(밀도, 생체량 모두 p < 0.05; t-test). 이처럼 연안은 소수의 종들이 우점적으로 출현하고 외해는 다양한 종들이 골고루 출현하는 경향이 있었다. 평균 chl-a 농도는 연안 그룹에서 표층 2.2 μg L-1, 수층 평균 2.9 μg L-1로, 외해 그룹의 표층 0.8 μg L-1, 수층 평균 1.7 μg L-1에 비하여 유의하게 높았다(p < 0.05; t-test).
연안 그룹에서 요각류 Acartia hongi와 그 유생이 정점별로 전체 밀도의 23.8–47.0%를 차지하며 다수 출현하였는데, 지표종 분석에서는 연안 그룹의 유일한 지표종으로 나타나(Table 2), 연안과 외해 그룹을 구분하는데 크게 기여하였다. 반면 외해 그룹의 경우 Oithona atlantica가 배타적으로 출현하는 지표종이었고, 그 외 난바다곤쟁이 유생, 모악류 미성숙체, 미충류 등 다양한 분류군이 지표종으로 분석되었다(Table 2).
Table 2.
Indicator values of the indicator species with Monte Carlo test of significance (p < 0.05)
중형동물플랑크톤과 환경 요인의 관계
중형동물플랑크톤 우점종 밀도와 환경 요인에 대해 중복분석한 결과, 제1축과 제2축의 고유치(eigenvalue)는 각각 0.55와 0.10이었고, 제1축에 의하여 우점종의 변동이 55.5% 설명되었으며, 두 축의 누적기여율(cumulative explained variation)은 65.3%였다(Table 3). 제1축과 제2축에서 4개의 환경요인은 우점종 변동의 83.6%를 설명하였다. 중형동물플랑크톤 종들의 경우 Acartia hongi, Centropages abdominalis, Calanus sinicus는 chl-a 농도와 양의 상관관계가 있었으며(Fig. 8), Paracalanus parvus s.l., Euphausiid calyptopis, Oikopleuridae는 염분 및 표층 수온과 양의 상관관계가 있었고, Oithona atlantica, O. similis, Euphausiid eggs와 nauplius는 수심과 양의 상관관계가 있었다. Acartia hongi와 chl-a 농도의 강한 상관관계는 Pearson 상관분석에서도 확인되었다(표층 0.883, p < 0.01; 수층 평균 0.604, p < 0.05).
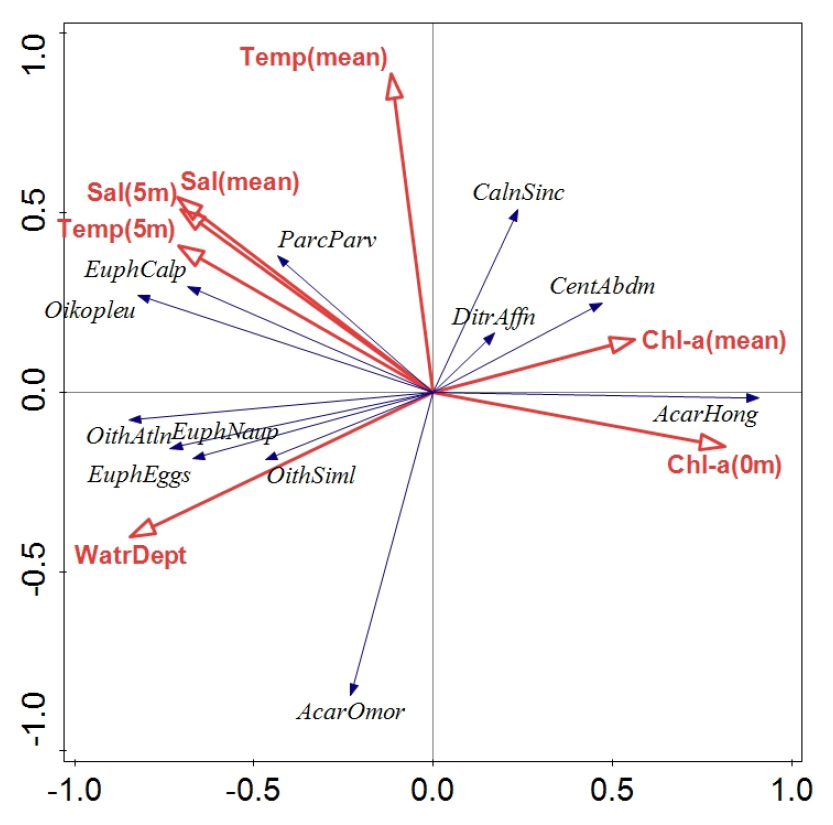
Fig. 8
Redundancy analysis biplot for the densities of dominant zooplankton species with the environmental factors (AcarHong: Acartia hongi, CalnSinc: Calanus sinicus, CentAbdm: Centropages abdominalis, DitrAffn: Ditrichocorycaeus affinis, ParcParv: Paracalanus parvus s.l., OithAtln: Oithona atlantica, OithSiml: Oithona similis, Oikopleu: Oikopleuridae, EuphEggs: Euphausiid eggs, EuphNaup: Euphausiid nauplius, EuphCalp: Euphausiid calyptopis)
Table 3.
Result of redundancy analysis for the mesozooplankton density in relation to water temperature, salinity and chlorophyll-a concentration
4. 고 찰
온대 해역에서 봄철에 일어나는 식물플랑크톤의 양적, 질적 변동은 이를 먹이로 하는 동물플랑크톤의 생물량과 종 구성에 중요한 영향을 주며(Thomas and Nielsen 1994; Longhurst 1995; Tommasi et al. 2013), 요각류의 성장과 생산은 식물플랑크톤 농도에 직접적이고 긍정적인 영향을 받는다(Peterson and Hutchings 1995; Hopcroft and Roff 1998; Richardson and Verheye 1998). 조사 해역인 황해는 봄철에 식물플랑크톤 대번성이 일어나고, 4월경에 chl-a 농도가 가장 높기 때문에(Fu et al. 2009; Liu et al. 2015), 같은 시기에 이루어진 이 조사의 동물플랑크톤도 chl-a 농도의 영향을 받았을 것으로 판단된다. 그 근거로 이 조사에서 중형동물플랑크톤 출현량 및 생체량은 chl-a 농도와 유의한 양의 상관관계가 있었고(Fig. 9), 중복분석 결과 우점종인 Acartia hongi, Centropages abdominalis와 chl-a 농도 사이에 양의 상관관계가 나타났다(Fig. 8). 다만, 우점종인 Oithona similis와 A. omorii의 경우 중복분석과 상관분석 모두에서 chl-a 농도와 유의한 관계가 없었고(Fig. 8; p > 0.05), O. atlantica의 경우 표층 chl-a 농도와 음의 상관관계를 보였다(-0.523, p < 0.05). 따라서 이 조사에서 전체 밀도와 생체량은 chl-a의 긍정적인 영향을 받은 것으로 보이지만, 종에 따른 반응은 다양한 것 같다.
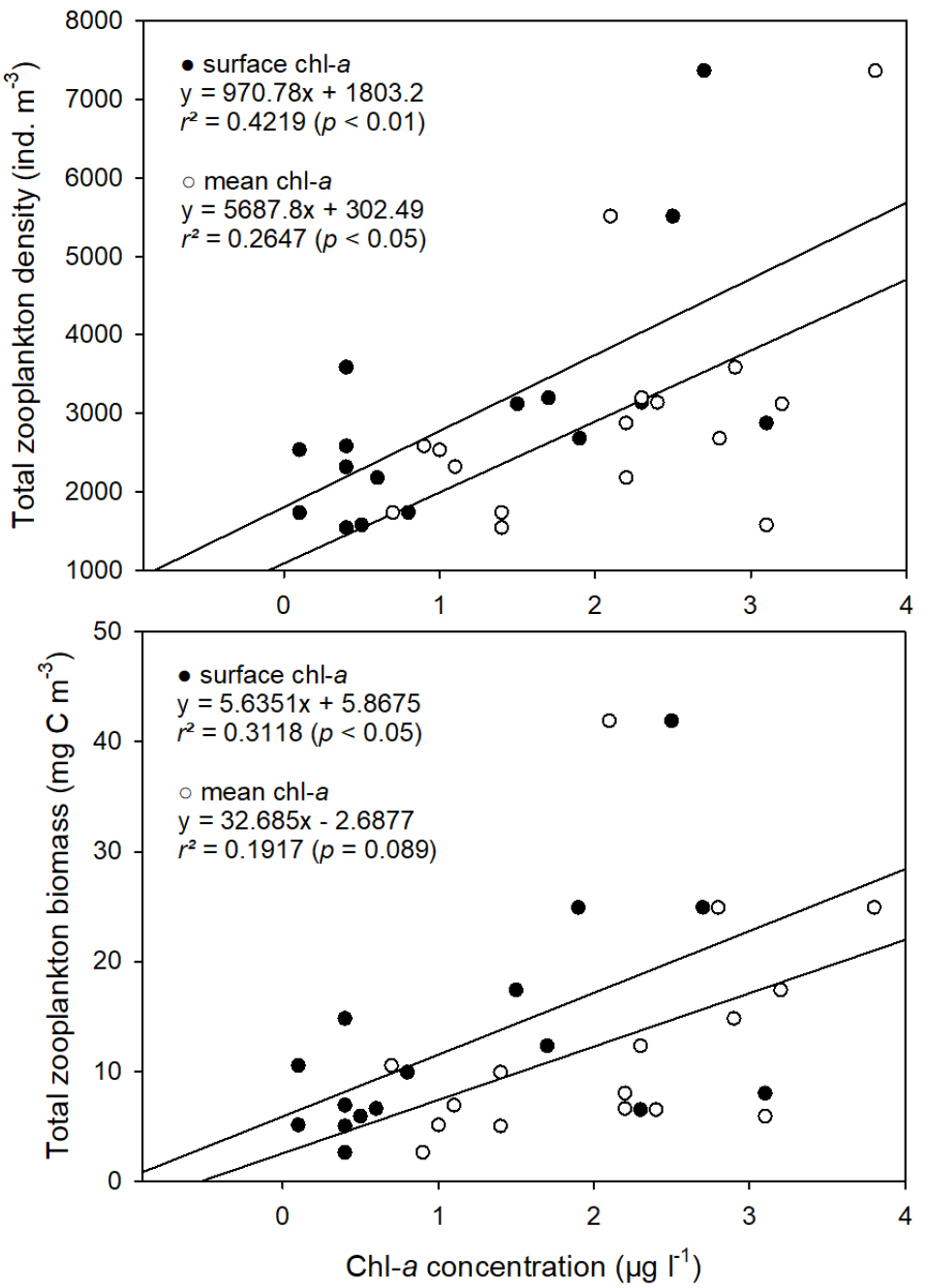
Fig. 9
Relationship between chlorophyll-a concentration and the total mesozooplankton density (above), and the total biomass (below). The filled circles (●) represent the chlorophyll-a concentration at the surface water at 0 m depth and the empty circles (○) are the water column mean chlorophyll-a concentration
이 조사에서는 요각류 Acartia hongi가 가장 우점하였고(Table 1), 집괴분석으로 구분된 연안 그룹의 지표종일 정도로 특히 연안역에 집중 출현하였다(Table 2; Fig. 6). 요각류 A. hongi는 비교적 최근에 분류학적으로 구분되었는데(Soh and Suh 2000), 주로 경기만에 다수 출현하며(Youn and Choi 2003), 남쪽으로는 진도 부근까지 출현하고(Soh and Jeong 2003; 최 등 2019), 광양항에서도 일부 출현한다(Kang 2011). Acartia hongi의 수온에 대한 반응은 일관되지 않는데, 광양항에 출현한 A. hongi 밀도의 계절 변동은 수온과 양의 상관관계가 있었지만, 인천항에서는 수온의 영향이 나타나지 않았다(Kang 2011). 인천 연안에서 약 1년간의 A. hongi 알 생산력은 수온과 음의 상관관계를 보이기도(유 등 2006), 양의 상관관계를 보이기도 하였다(Youn and Choi 2007). 이는 아마도 수온 변화 폭이 1.6–25.6°C에 이른 인천 연안처럼(유 등 2006), 만이나 항구의 경우 폐쇄된 얕은 지형으로 인해 수온의 연 변동이 크기 때문일 것이다. 반면, 인천 연안에서 A. hongi의 알 생산율은 chl-a 농도와 양의 상관관계가 있었고(유 등 2006), 경기만에서 A. hongi의 알생산력은 chl-a의 계절 변동과 비슷한 양상을 보였는데(Youn and Choi 2007), 이 조사에서도 chl-a 농도가 A. hongi의 밀도에 긍정적인 영향을 주었음을 확인할 수 있었다(Fig. 8). 다만, A. hongi가 먹이로서 식물플랑크톤보다 섬모충류를 포함한 소형동물플랑크톤을 선호하고(양과 최 2009; Yang et al. 2010), 경기만에서 규조류 대번성 시기에는 A. hongi 먹이원 탄소의 약 60%가 식물플랑크톤으로부터 기인(Yang et al. 2010)한 것으로 보아, 이 종의 먹이가 가변적일 수 있다는 점도 고려해야 한다. 따라서, 황해 조사 해역 정점들의 수온, 염분 간에 큰 차이가 없었고, 시기적으로 봄철 식물플랑크톤이 번성하였고, chl-a 농도가 연안에서 특히 높았음을 종합해보면, 이 연구에서 A. hongi의 분포와 밀도는 먹이로 대표되는 식물플랑크톤의 chl-a 농도의 영향을 받은 것으로 판단된다.
Oithona 속에 속하는 요각류는 전 세계 해양에서 가장 풍부하고 넓게 분포하는 요각류로서(Gallienne and Robins 2001), 우리나라 전 해역에서도 우점하여 출현한다(서 등 2018). 황해에서 Oithona similis는 연중 출현하지만, 출현 시기나 출현량에 경향성은 찾을 수 없는데, 제한된 공간에서 소수 출현하기도(황과 최 1993; 장과 김 1998), 우점종이 될 만큼 다수 출현하기도(심 등 1988; 임 등 2009)하며, 이 조사에서도 상위 우점종으로서 다수 출현하였다(Table 1). Oithona 요각류의 호흡률과 알 생산력은 수온과 먹이 농도의 영향을 받는다고 알려져 있다(Sabatini and Kiørboe 1994; Castellani et al. 2005). 그러나 이 조사에서 Oithona similis의 밀도는 환경 요인과의 중복분석에서 수심과 상관이 있었고(Fig. 8), 분포에서도 chl-a 농도가 높았던 연안보다 외해 쪽에서 더 많이 출현하여(Fig. 6), 수온이나 먹이 농도의 영향을 확인할 수 없었다. 또한 유사 해역에서의 가을철 조사에서도 O.similis의 밀도는 수온, chl-a 농도 보다는 염분과 상관관계가 있었다(김과 강 2019). 또 다른 Oithona 출현 종인 Oithona atlantica의 경우 황해 조사 해역에서 수심과 양의 상관관계를 보였으며(Fig. 8), 외해 그룹에서만 출현하는 배타적 지표종으로 나타났다(Table 2). 일본의 Toyama bay에서 O. similis의 nauplii는 표층에 주로 분포하지만, O. atlantica의 nauplii는 더 깊은 수심에 분포하면서 더 강한 수직운동을 보였다고 보고된 것처럼(Takahashi and Uchiyama 2008), 이 조사에서 O. atlantica의 분포 또한 수심의 영향을 받았을 가능성이 있다.
요각류 Centropages abdominalis의 밀도는 중복분석 결과 chl-a와 양의 상관관계가 있었으나(Fig. 8), chl-a의 분포와 달리 연안뿐 아니라 외해에서도 고루 출현하였다(Fig. 6). Centropages는 다른 요각류나 어류의 알과 유생을 포식하여 이들의 개체군 변동에 영향을 줄 정도로 잡식성이 강하기 때문에(Conley and Turner 1985; Turner 1987), 이 연구에서도 초식성인 Acartia hongi 보다 chl-a의 분포에 좌우되지 않고 고른 분포를 보인 것 같다. 그러나 이전 연구에서는 C. abdominalis의 계절적 출현과 분포가 수온의 영향을 크게 받는 것으로 보고되었다. 알래스카만에서 C. abdominalis는 표층 수온이 10–14°C일 때에만 출현하였고(Coyle et al. 1990; Slater and Hopcroft 2005), 일본내해에서는 겨울철과 봄철에만 출현하며 수온이 10°C 이하일 때 출현량이 가장 높았다(Liang et al. 1996). 우리나라 근해에서도 C. abdominalis는 저온성 연안종으로 알려져 있는데(NIBR 2010), 황해에서 주로 겨울과 봄에 출현하였고(심 등 1988; 장과 김 1998; 국토해양부 2009), 가을철 조사에서는 이 종이 출현하지 않았다(김과 강 2019). 따라서 이 조사에서 봄철에 C. abdominalis의 밀도는 chl-a 농도의 영향을 받았지만, 계절 조사를 반영하게 된다면 수온과 더 유의한 관계가 있을 가능성이 있다.
우리나라에서 발표된 황해 동물플랑크톤 군집 연구 중 봄철 결과를 이 연구와 비교해 보면, 출현 종들의 구성은 거의 유사하지만 종의 비중은 차이가 있었다. 이 연구에서 크게 우점하지 않은 Paracalanus parvus s. l.과 Ditrichocorycaeus affinis가 이전 연구에서는 상위 우점종으로 나타났다(심 등 1988; 황과 최 1993). 장과 김(1998)의 연구에서는 Acartia omorii가 최우점 종이었고, Calanus sinicus가 전체 밀도의 9% 이상을 차지하며 차우점 하였다. Kang and Kim (2008)의 연구에서도 C. sinicus는 봄철 황해에서 최우점하는 요각류였고, P. parvus s. l.이 차우점 종이었다. 반면에 이 조사에서는 A. omorii와 C. sinicus가 전체 밀도의 각각 3.5%와 1.9%를 차지하며, 전체 중형동물플랑크톤 조성률의 70% 이내에 포함되지 않았다. 한편, Kang and Kim (2008)이 제시한 수온, 염분, chl-a 농도와 우점종 사이의 주성분 분석 결과에서 P. parvus s. l.이 수온과 관계가 있고, Centropages abdominalis가 chl-a 농도와 관계가 있던 것은 2019년의 이 연구와 비슷하지만(Fig. 8), C. sinicus와 수온과의 유의한 관계는 이 연구에서는 확인할 수 없었다.
Calanus sinicus는 황해에서 봄철에 다수 출현하는 것으로 알려져 있는데(Kang and Kim 2008; Chen et al. 2011; Liu et al. 2012), 이 조사에서는 C. sinicus가 상위 우점종에 포함되지 않았다(Table 1). 황해에서 여름철에 출현하는 C. sinicus의 생존, 발생, 대사, 분포는 수온과 먹이 농도의 영향을 받는 것으로 보고된 바 있으나(Pu et al. 2004), 봄철의 경우에는 어떤 환경 요인이 C. sinicus의 밀도에 영향을 주었는지 아직 분명하지 않다. Kang and Kim (2008)은 황해에서 봄철에 C. sinicus의 밀도는 chl-a 농도와 관련이 없고, 평균 수온과 양의 상관을 보인다고 하였으며, 식물플랑크톤이 풍부할 경우 먹이 제한이 없기 때문에 먹이보다는 수온의 영향을 받는다고 고찰하였다. 그러나 이 연구에서 C. sinicus는 chl-a 농도와 유의한 양의 상관을 보였으며(Fig. 8; 0.512, p < 0.05), 수온과는 상관을 보이지 않았다. 이러한 차이는 조사 해역의 물리 환경 특성의 차이로 추정되는데, 이전 연구에서는 황해저층냉수가 영향을 미친 것으로 나타났으나, 이 조사에서는 수온약층이 강하지 않았고 염분도 균질한 분포를 보여, 상대적으로 chl-a의 영향이 강했던 것으로 추정된다. 황해에서 C. sinicus는 잡식성인 것으로 보고되었으나, 식물플랑크톤 번성기 동안에는 식물플랑크톤을 주로 섭식하므로(Yi et al. 2017), 조사 시기인 봄철에는 chl-a가 먹이를 대표한다고 볼 수 있다. 또한 황해에서 C. sinicus의 현장 알 생산력도 식물플랑크톤 번성기인 봄철에 높게 나타나는 것(Kang et al. 2011)으로 보아, 다른 계절에 비해 봄철에는 C. sinicus의 밀도와 분포에 식물플랑크톤 대번성의 영향이 큰 것으로 해석된다.
5. 결 론
봄철 황해 조사 해역의 중형동물플랑크톤 군집은 연안과 외해로 크게 구분되었다. 연안은 외해에 비해서 중형동물플랑크톤의 밀도, 생체량, chl-a 농도가 높으면서 소수종에 의한 우점도가 높았으며, 외해는 소수종에 의한 우점도는 낮지만 다양한 종이 골고루 분포하는 특징을 보였다. 전체 중형동물플랑크톤의 출현량은 chl-a 농도와 양의 상관을 보였지만, 중형동물플랑크톤의 chl-a에 대한 반응은 종에 따라 차이를 보였다. 최우점 요각류인 Acartia hongi는 연안 그룹의 지표종으로서 나타났는데, chl-a 농도가 이 종의 밀도에 강한 영향을 주였다. 황해 광역의 이전 연구와 비교했을 때 출현 종의 구성은 큰 변화가 없었으나, 이전 연구에서는 우점종에 포함된 요각류 Acartia omorii와 Calanus sinicus가 이 연구에서는 상위 우점종에 포함되지 않았다. 또한, 이전 연구에서 황해 봄철의 C. sinicus는 수온과 유의한 관계를 보였으나, 이 연구에서는 chl-a 농도와 더 관련이 있었다. 따라서 황해 광역의 봄철 중형동물플랑크톤의 분포와 출현량 및 종 구성은 수온, 염분보다는 chl-a 농도의 영향을 더 받는 것 같다.