1. 서 론
부식 물질(humic substances)은 고분자 유기화합물의 난분해성 복합혼합물로(Aiken et al. 1985), 복합적인 구조를 가지고 있어 광화학 반응과 흡착 및 응집 반응을 유도하며 금속과 결합하는 등 다양한 특성을 보인다(Tranvik and Wachenfeldt 2009). 하천과 강에서 부식 물질은 용존유기탄소(DOC)의 40–70%를 차지하고 해수에서는 담수환경보다 더 낮은 비율(25%)을 보이는 것으로 보고되었다(Thurman 1985; Adey and Loveland 2007). 부식 물질은 대부분이 풀빅산(fulvic acid) 형태이며, 15%정도가 부식산(Humic Acids, HA)으로 이루어져 있다(Packham 1964; Stuermer and Harvey 1977; Stuermer and Harvey 1977). 이러한 난분해성 부식 물질이 박테리아와 같은 미생물뿐만 아니라 일부 해양 식물플랑크톤(와편모조류, 규조류)의 반응 및 성장을 촉진할 수 있고, 이 때 풀빅산보다 부식산이 더 효과적인 것으로 보고된 바 있다(Prakash et al. 1973; Prakash and Rashid 1968).
하구는 개방 해역과 연결되어 있는 반폐쇄성 해역으로 하천으로부터 유입되는 담수와 조석주기에 따라 들어오고 나가는 해수가 혼합되어 기수역을 형성하는 하천과 바다의 전이지역이다. 충분한 영양물질, 성층과 혼합 등의 수층 구조로 인해 유기물이 많이 생성되는 가장 생산적인 해양 환경 중에 하나이며(Ryther 1969; McLusky and Elliot 2004), 동시에 고유한 하구 순환으로 인해 육상과 해양기원의 유기물이 물리적으로 혼합되면서 해양의 유기탄소 플럭스(flux)를 결정하는 역할을 한다(Hedges and Keil 1999; Duan and Bianchi 2006; Middelburg and Herman 2007; Canuel and Hardison 2016). 이와 같은 전형적인 하구들과 달리 영산강 하구는 1981년에 하굿둑이 건설되면서 담수역과 해수역이 분리되어 고유한 하구 순환을 상실한 변형된 하구가 되었다. 하굿둑에 위치한 배수갑문이 닫힌 상태에서 담수역은 정체된 호소환경을 유지하는 반면, 해수역은 조석의 영향을 받는 반폐쇄성 만(bay)의 형태를 띠게 된다. 하지만 배수갑문이 개방되면 일시적으로 담수역의 담수가 대량으로 유입되면서 해수역 특히 하굿둑에 인접한 해역은 급격한 환경 변화를 겪게 된다. 선행연구에서 담수 유입은 해양 수질뿐만 아니라 일차생산자인 식물플랑크톤 심지어는 와편모조류와 같은 적조 생물의 변동에도 영향을 주는 것으로 나타났다(윤 등 2013; Sin et al. 2013; Sin and Jeong 2015). 더욱이 담수와 함께 유입되는 난분해성 부식 물질이 포함된 유기물은 하구생태계에 직·간접적으로 영향을 줄 것으로 예상된다. 하지만 이러한 부식 물질에 대한 하구 미생물들의 반응은 아직까지 잘 알려져 있지 않은 상태이다(Lipczynska-Kochany 2018).
하구에서 이러한 부식 물질의 영향을 파악하기 위해서 먼저 식물플랑크톤의 반응을 파악할 필요가 있다. 하구 먹이망의 일차생산자인 식물플랑크톤은 육상에서 전달되는 영양물질을 이용하여 많은 유기물을 생산하는 주요 미생물이고, 일부 하구 및 해양 종들의 성장은 부식 물질의 영향을 직접적으로 받기 때문이다(Prakash and Rashid 1968; Prakash et al. 1973; Carlsson and Granéli 1993; See et al. 2006). 다만 선행연구는 실험실 내에서 이루어진 microcosm 실험이 주로 활용되었다. 본 연구에서는 영산강 하구 해수역에서 채집한 시료를 이용하여 현장의 자연적 환경 조건을 최대한 재현하는 메소코즘(mesocosm) 배양 실험을 통해 부식산 첨가에 대한 식물플랑크톤의 반응을 파악하였다. 다만 식물플랑크톤의 물리적, 화학적 환경 변화에 대한 반응은 세포 크기에 따라 다르게 나타날 수 있기 때문에(Álvarez-Góngora and Herrera-Silveira 2006), 식물플랑크톤을 net-size (> 20 µm) 및 nano-size (< 20 µm) 로 구분하여(size-fractionation) 조사하였다. 최근 영산강 하구의 담수역을 대상으로 실시한 메소코즘 실험 결과가 보고되었지만(Sin and Kim 2022), 해수역의 식물플랑크톤 반응에 대한 연구결과는 아직까지 보고된 적이 없다. 따라서 본 연구는 부식산에 대한 식물플랑크톤의 반응을 파악함으로써 영산강 하구와 같이 불특정적이고 부정기적인 담수 유입이 존재하는 변형 하구의 유기물 거동 이해와 효율적인 수질관리에 기여할 수 있을 것이다.
2. 재료 및 방법
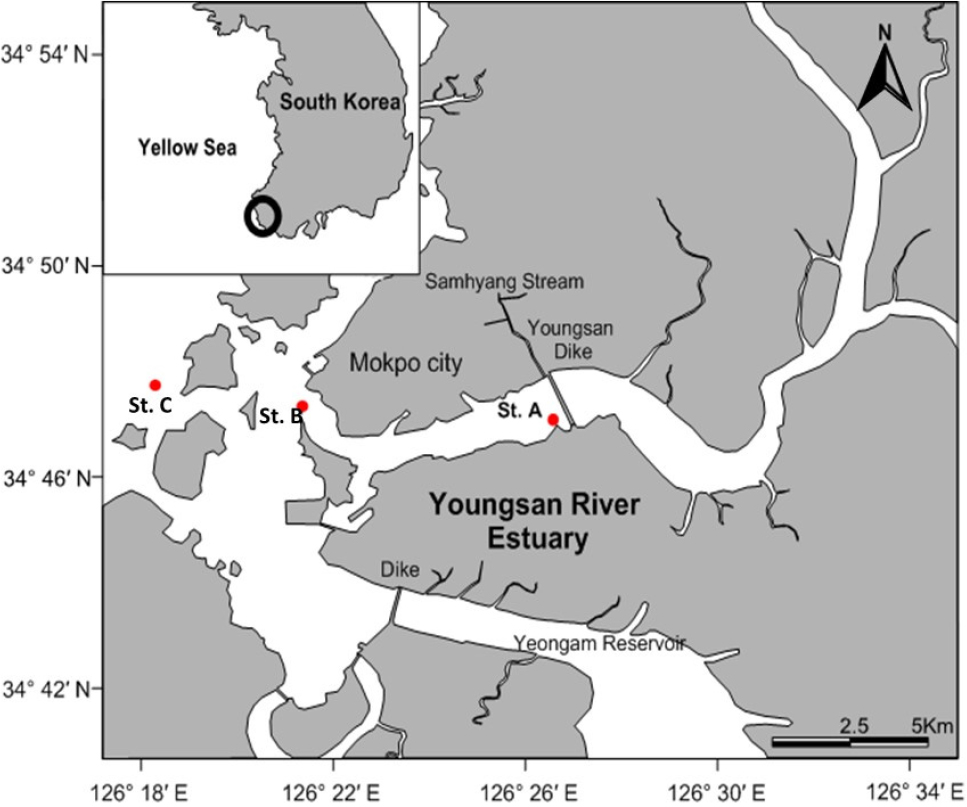
본 연구는 현장 조사와 메소코즘(mesocosm) 실험 조사로 구분된다. 현장 조사는 배양실험용 시료 채취 및 현장의 환경조건 확인을 목적으로 영산강 하구 해수역의 3개 정점에서 2009년 2월·5월·8월·11월(총 4회)에 실시되었다(Fig. 1). 하구의 물리·화학적 환경 특성(수온, 염분, 용존산소, 탁도)은 YSI-6600v2 multiprobe를 이용해 표층에서 측정하였으며, 수중의 빛 강도는 특정 수심(1.1 m)에서 PAR Quantum Radiometer (LICORⓇ)를 사용해 측정하였다. 아질산성 질소+질산성 질소(NO2-+NO3-), 암모니아성 질소(NH4+), 인산염(PO43-), 규산염(DSi)을 포함하는 영양물질 분석은 Autoanalyzer (TRAACS 2000, BranLuebbeⓇ)를 이용하였다. 용존무기질소(DIN), 용존무기인(DIP)의 비(molar ratio)를 분석하여 잠재적 제한 영양염을 추정하였다. DIN은 암모니아성 질소(NH4+)와 아질산성질소+질산성질소(NO2-+NO3-)의 합, DIP는 인산염(PO43-)을 의미한다.
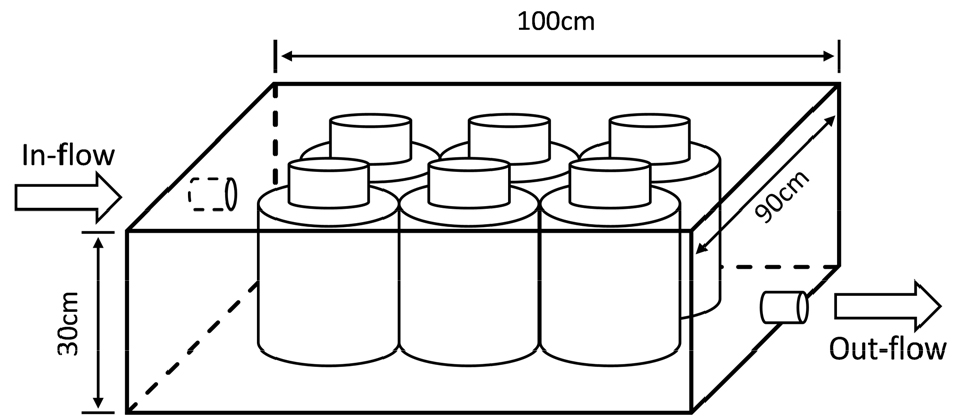
메소코즘 실험 배양을 위해 현장 조사 3개 정점의 표층에서 시료를 채집하였으며, 식물플랑크톤 포식자를 제거하기 위하여 70 µm 여과망을 통해 여과하였다. 여과된 시료를 투명한 PC (polycarbonate)병에 채우고 부식산(Sigma-AldrichⓇ, St. Louis, MO, USA)을 첨가한 처리군(HA treatment; 5 ppm)과 첨가하지 않은 현장수인 대조군(control)으로 분리하여 배양 실험을 실시하였다. 배양 시 시작된 시점에서 일정기간(7–20일) 동안 시료를 반복 채집(replicate)하여 식물플랑크톤 반응 정도를 파악하였다. 배양을 위해 제작된 수조(Fig. 2)를 영산강 하구 해수역 인근에 설치하였고 현장의 조건을 재현하기 위해 해수가 수조안에서 지속적으로 순환할 수 있도록 설계하였다.
식물플랑크톤 크기구조는 세포 크기에 따라 2개 그룹(net-size (> 20 µm), nano-size (< 20 µm))으로 분류하여 분석하였다. 이 분류를 위해 20 µm Nytex mash를 이용해서 여과한 후 여액을 유리섬유 여과지(GF/F filter, 직경 25 mm, Whatman, pore size 0.7 µm)를 이용해서 여과하였다. 사용된 필터지를 아세톤 90% 8 mL가 담긴 차광 시험관에 넣고 24시간 내로 Turner DesignsⓇ 10-AU Fluorometer를 사용하여 chlorophyll-a를 측정한 후 각각의 농도 값을 계산하여 크기별 chlorophyll-a를 산출하였다.
부식산 첨가에 따른 크기별 식물플랑크톤 반응을 분석하기 위해 프로그램 R 소프트웨어(ver. 6)를 이용하여 반복측정 분산분석(Repeated Measures ANOVA)을 수행하였다.
3. 연구결과
해수역의 수문, 물리·화학적 특성 및 식물플랑크톤 변동
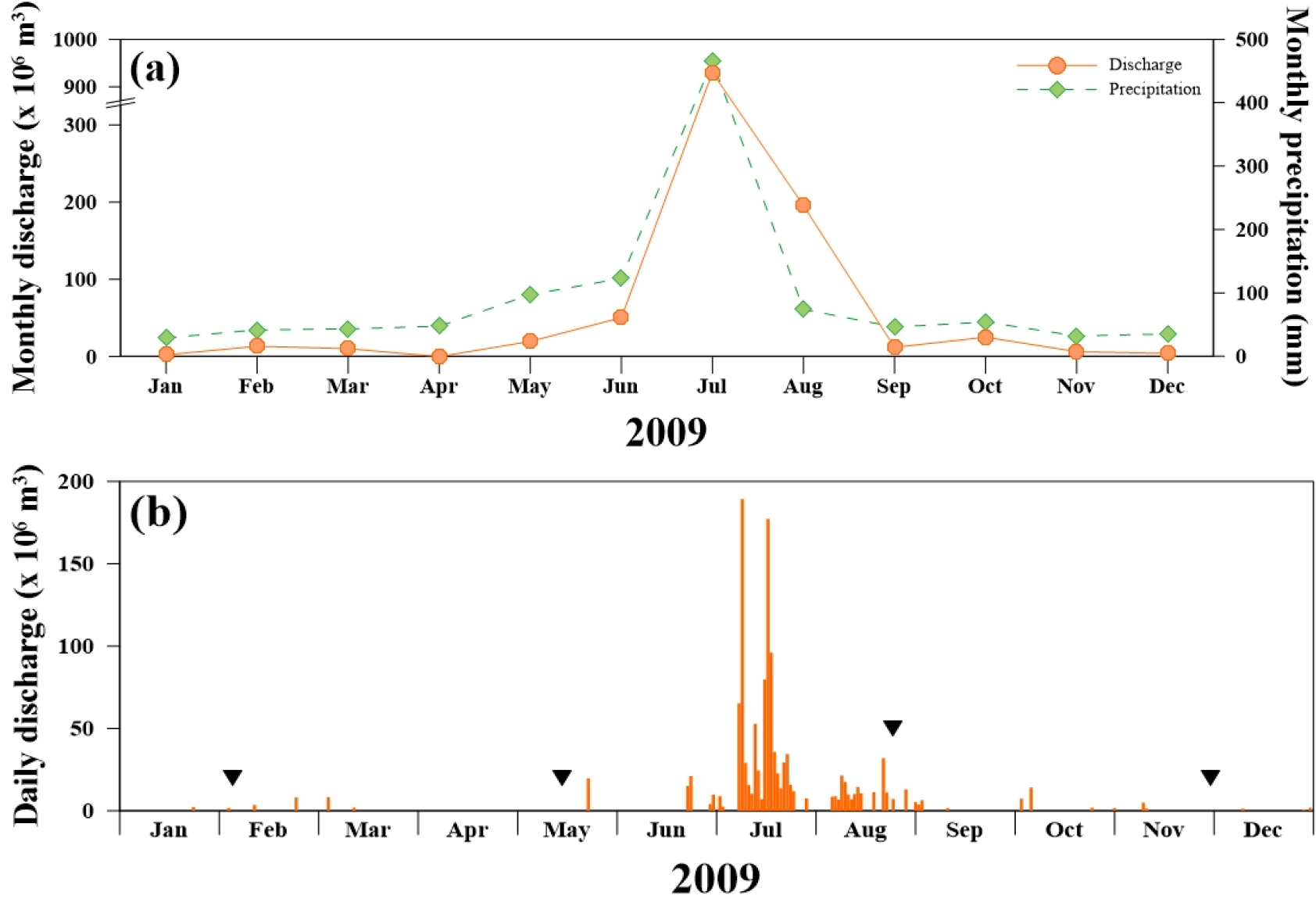
영산강 하구 지역의 2009년 강수량은 풍수기인 여름철에 증가하는 전형적인 몬순기후의 특징을 나타냈다(Fig. 3). 또한 강수량이 많았던 시기에는 담수 방류량도 증가하는 양상을 보였다. 모든 조사시기에는 당일 방류가 실시되지 않았으나 2월, 8월의 조사 5일 전에는 최소 한번 이상의 강수와 방류가 발생한 것으로 확인되었다(Table 1). 특히 8월에 조사 전 5일 동안 강수량이 24.5 mm로 가장 높았으며 방류량 역시 43.08×106 m3으로 가장 많았다. 5월과 11월에 조사 1–2일 전 2.0–10.0 mm의 강수가 발생하였으나 방류는 확인되지 않았다.
Table 1.
Freshwater discharge from the sluice gates and precipitation in the area of Mokpo during the sampling date (D) and 5 days before the sampling (D-1 to D-5)
수온은 6.17–25.57℃의 범위로 나타났으며 여름에 높고 겨울에 낮은 계절적인 분포를 보였다(Table 2). 공간적인 수온의 분포는 담수역 및 하굿둑과 가까운 St. A에서 상대적으로 높게 나타냈다. 용존산소(DO)는 2월에 10.57–12.19 mg/L 분포를 보였으나 5월부터 11월까지 6.93–8.33 mg/L의 농도로 봄–가을 동안 상대적으로 낮은 분포를 유지하였다. 염분은 지속적으로 발생한 강우와 방류로 인해 8월에 24.52–30.10 psu로 급격한 감소를 보였다. 또한 공간적 분포는 담수역과 하굿둑에 인근 정점일수록 낮은 경향을 나타냈다. 탁도 또한 염분과 유사하게 St. A에서 가장 낮은 분포를 나타내며, 외해인 St. C로 갈수록 높은 경향을 보였다. 광량(PAR)은 계절적으로 봄철인 5월에 372.50–1105.00 μmol/m2/s로 높은 분포를 나타냈으며 다른 시기 동안에는 142.87–572.70 μmol/m2/s로 유지하였다.
Table 2.
Physical and chemical water properties in the seawater of the Yeongsan River estuary
|
Sampling Date | Station |
Temp. (°C) |
DO (mg/L) |
Sal. (psu) |
Turb. (NTU) |
PAR (µmol/m2/s) |
| Feb | A | 6.53 | 12.19 | 31.80 | 8.20 | 203.00 |
| B | 6.17 | 10.58 | 32.37 | 13.70 | 572.70 | |
| C | 6.22 | 10.57 | 32.93 | 13.00 | 142.87 | |
| May | A | 16.65 | 7.56 | 31.15 | 0.70 | 1105.00 |
| B | 15.93 | 7.73 | 33.10 | 7.80 | 682.70 | |
| C | 16.06 | 7.51 | 33.26 | 17.20 | 372.50 | |
| Aug | A | 25.57 | 6.93 | 24.52 | 2.90 | 323.20 |
| B | 24.60 | 7.26 | 27.80 | ND | 467.30 | |
| C | 24.00 | 7.02 | 30.10 | ND | 277.40 | |
| Nov | A | 12.53 | 8.07 | 32.28 | 5.10 | 394.00 |
| B | 12.33 | 7.59 | 32.78 | 7.30 | 201.50 | |
| C | 12.27 | 8.33 | 32.74 | 11.30 | 153.81 |
영양물질 중 아질산성 질소+질산성 질소는 5.67–38.54 µM의 농도 분포로, 계절적인 변동을 보이지 않았으나 2009년 8월에 16.42–38.54 µM 로 높은 경향을 나타냈다(Table 3). 암모니아성 질소 또한 동일한 8월에 2.33–88.29 µM의 높은 분포를 나타냈으며 다른 계절 동안에는 0.67–10.31 µM 분포를 유지하였다. 이에 따라 용존무기질소는 여름철에 가장 높은 분포를 나타내었다. 용존무기인은 2009년 8월과 11월에 0.32–1.36 µM로 높은 분포를 유지하였으며 이 기간 동안 공간적인 분포는 St. A에서 가장 높게 나타났다. 규산염은 인산염과 동일한 양상으로 8월, 11월에 14.10–49.15 µM로 높은 농도를 보였다. 모든 영양물질의 분포는 일정한 양상을 나타내지는 않았으나 전반적으로 2009년 8월에 높은 분포를 보였다. N:P ratio (DIN/ DIP)는 가을을 제외하고 대부분 16보다 큰 값을 보이면서 인(P)이 잠재적인 제한 영양물질로 나타났다.
Table 3.
Nutrient concentrations in the seawater of the Yeongsan River estuary during the sample collection
Table 4.
Total, net-, and nano-sized chlorophyll-a concentrations (µg/L) and contribution percentage (%) of net- and nano-size classes (in parenthesis) during the sample collection
식물플랑크톤 생체량의 지표인 chlorophyll-a의 분포는 0.77–21.16 µg/L 범위를 나타냈다(Table 4). 2월과 8월에 1.26–21.16 µg/L로 가장 높은 분포를 보였으며 공간적으로는 St. A에서 높은 경향을 나타냈다. 특히 2월 St. A에서 급증하는 양상을 보이기도 하였다. 11월에는 0.77–0.79 µg/L 농도를 유지하며 모든 정점에서 낮은 분포를 나타냈다. Nano-sized chlorophyll-a (< 20 µm)의 분포 또한 유사한 양상을 나타냈으며, 상대적으로 net-size chlorophyll-a (> 20 µm)보다 높은 분포 경향을 보였다. 크기구조 분포는 nano-size 기여율이 모든 정점에서 63.41–98.68%로 유지되었으며 net-size의 기여율은 1.3–36.59%로 낮은 분포를 보였다. 따라서 모든 조사 기간 동안의 크기구조는 nano-size의 식물플랑크톤이 높은 기여율을 보이는 것으로 확인되었다.
부식산 첨가에 대한 크기별 식물플랑크톤 반응
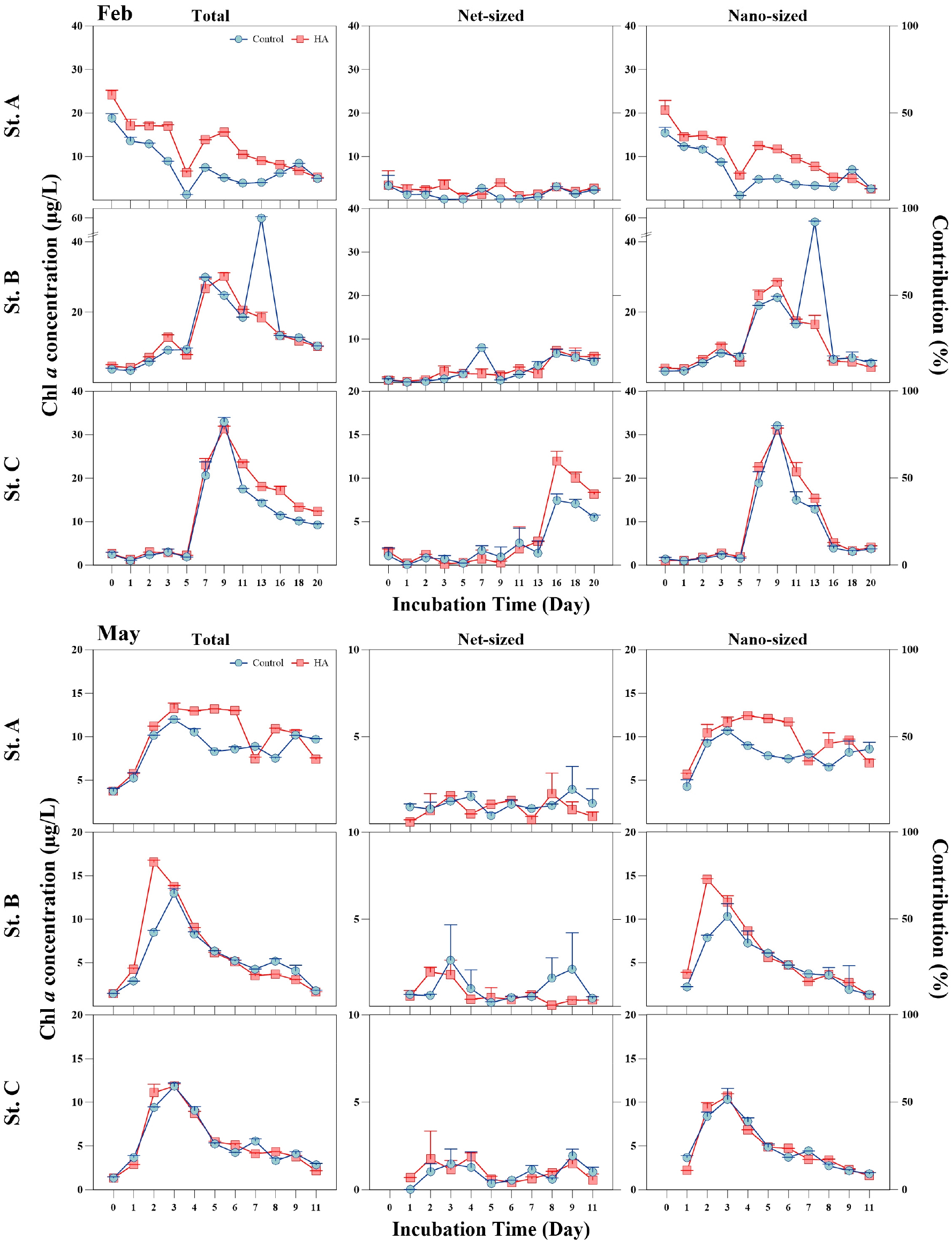
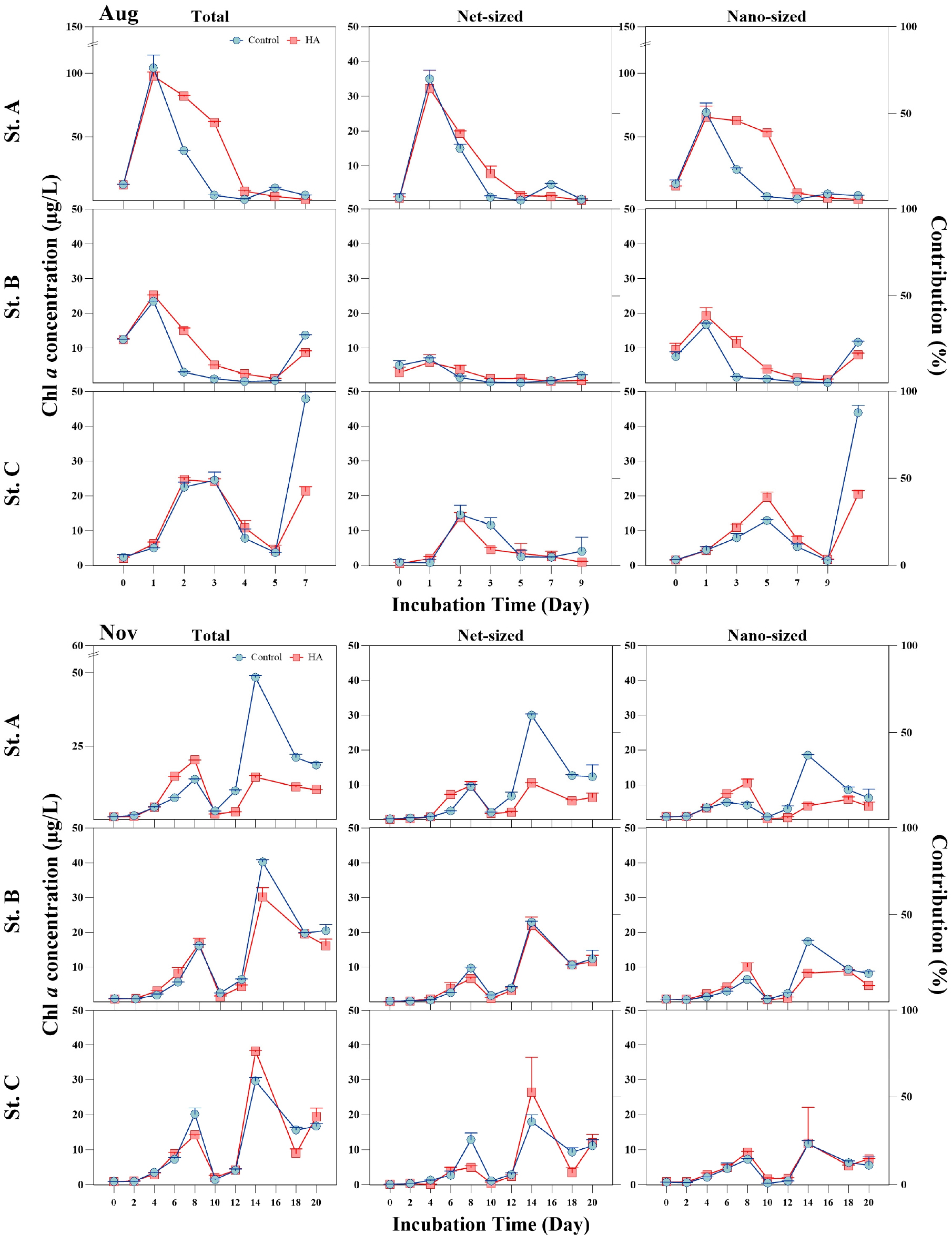
부식산에 첨가에 따른 식물플랑크톤 반응 정도를 알아보기 위한 배양실험 결과(Figs. 4 and 5)를 분석하였다. 또한 식물플랑크톤 크기를 구분하여 크기에 따른 반응 정도도 확인하였다. 부식산 첨가 후 식물플랑크톤 반응은 시기별로 모두 상이하게 나타났으며 일부 시기에는 반응을 보이지 않았다. 2월에는 St. A만 전체적으로 반응하였으며 St. B와 St. C에서 일정한 반응을 보이지 않았거나 배양 11일 이후에 반응을 보였다(Fig. 4). 5월에 St. A와 B의 total, nano-size가 배양 초·중기에 일부 반응을 나타냈다. 8월에는 St. C를 제외한 다른 정점에서 일부 배양시기에만 반응을 보였다(Fig. 5). 11월에는 일시적인 반응을 나타내며 공간적 및 크기별로 상이한 결과를 보였다. 크기별 식물플랑크톤의 반응은 total-size와 nano-size에서 유사한 경향을 나타냈으며 net-size보다 nano-size의 식물플랑크톤에서 상대적으로 높은 반응을 보였다. 그러나 전반적으로 시공간적으로 부식산 첨가에 따라 유의하게 반응한 결과는 모두 상이하였다. 통계분석 결과에서도 net-size 식물플랑크톤 반응은 모두 유의한 결과를 나타내지 않았으며 일부 반응을 보인 St. A와 B에서 nano-size 식물플랑크톤이 유의한(p< 0.05) 반응 결과를 보였다(Table 5).
Table 5.
Results of repeated measures analysis of variance (RM-ANOVA) on control and HA addition treatment for total, net-, and nano-sized chlorophyll-a at a significance level of 0.05. Time and Trt (treatment) represent the differences over time and between the treatments (control vs. HA addition) respectively and T*Trt represents differences between the treatments and over time. Significant p-values (< 0.05) are highlighted in gray
4. 고 찰
부식산은 자연 수 환경 및 토양에서 활용가능한 산화환원 활성 화합물질이다. 특히 토양과 같은 유기물이 풍부한 환경에서는 부식 물질이 광범위한 산화환원 반응 네트워크에 관여하는 것으로 보고된 바 있다(Eljarrat 2012). 토양 내 부식 물질은 영양물질을 유지하고 식물에 흡수하는 과정이 필수적이기 때문에 과거부터 연구되어왔으나 수 환경의 부식 물질은 토양에 비해 비교적 최근에 그 중요성이 인식되었다(Filella et al. 2005).
부식 물질은 넓은 pH범위에서 물에 대한 용해도에 따라 부식산(pH2 이하에서 불용성)과 풀빅산(모든 pH에서 용해), 휴민(불용성)을 비롯한 여러 물질로 구성된다. 부식산은 분자량이 더 크고 방향족이 더 많은 반면, 풀빅산은 분자량이 더 낮고 지방족이 더 많은 경향이 있다(Thurman 1985). 불용성인 휴민을 제외한 부식산과 풀빅산은 수중 생물들에 의해 생물학적으로 이용 가능한 것으로 간주되고 있다(Lipczynska-Kochany 2018). 본 연구에서는 부식산 첨가가 하구 해수역의 식물플랑크톤의 생체량 증가에 기여하는 것으로 나타났다. 특히 크기가 큰 net-size의 식물플랑크톤보다는 작은 크기의 nano-size 식물플랑크톤이 민감하게 반응하였다(Table 5, Figs. 4 and 5). 이는 부식 물질이 식물플랑크톤 변동 나아가 하구 생태계에 영향을 미칠 수 있는 가능성을 보여주는 결과라 할 수 있다.
영산강 하구는 하굿둑으로 인해 담수역과 해수역으로 분리된 상태를 유지하고 있다. 다만 담수역 수위 조절을 위해 하굿둑 배수갑문이 열리면서 많은 양의 담수가 유입되고, 이는 해수역의 염분, 수온, 탁도, 영양물질 등의 분포에 직접적인 변동을 야기한다(Sin et al. 2013; Sin and Jeong 2015). 그 중에서도 특히 염분의 급격한 변화를 초래하는데 본 연구에서도 8월의 경우, 현장조사 2일 전에 담수가 방류되면서 하굿둑 인근 정점에서 염분이 24.52 psu까지 하락하는 것으로 나타났고(Tables 1 and 2) 이러한 염분 감소는 수중 생물들에게 스트레스로 작용할 가능성이 있다. 하지만 담수 유입은 동시에 영양물질, 유기물 등의 농도 증가에도 기여함으로써(이 등 2013) 일시적으로 하구의 연속성(river continuum)을 보이기도 한다(Sin et al. 2015). 본 연구에서도 8월에 영양물질(NO2-+NO3-, NH4+, PO43-, DSi) 농도가 높아지는 것을 확인할 수 있다(Table 3). 결국 담수를 통해 부식 물질 역시 해수역으로 유입될 수 있고 이는 식물플랑크톤과 같은 일차생산자 변동에 영향을 줄 수 있다. 더욱이 최근 영산강 하구 담수역의 COD/BOD ratio가 유의하게 증가하고 있는 경향(Sin and Lee 2020)을 고려했을 때 부식 물질과 같은 난분해성 유기물 유입이 점차 증가하고 있는 것으로 추정된다. 이러한 난분해성 유기물의 증가는 수생태계의 일차생산자인 식물플랑크톤에 대한 영향력이 향후 더욱 가중될 가능성을 내포하고 있다.
본 연구에서 부식산 첨가에 대한 식물플랑크톤의 반응은 크기별로 상이하였다(Figs. 4 and 5). 크기가 큰 net-size보다는 작은 nano-size에서 민감한 반응을 보였다. 이는 담수역을 대상으로 실시한 부식산 첨가 실험 결과와 유사하다(Sin and Kim 2022). 다만 담수역에서는 nano-size의 Stephanodiscus sp.와 같은 우점종이 그 반응의 주체였지만 본 연구에서는 종 조사가 이루어지지 않아 종 수준에서의 반응은 파악할 수 없었다. 향후 종에 대한 조사가 필요할 것으로 사료된다. 다른 환경변화에 대해서도 식물플랑크톤의 크기별 반응은 상이하게 나타났다(Hein et al. 1995; Totti et al. 2005). 부식 물질을 포함해서 다양한 환경변화에 대한 크기별 반응의 특이성은 식물플랑크톤의 크기구조 변화를 초래하고 나아가 해양생태계 먹이망의 구조에도 영향을 줄 수 있음을 암시한다(Froneman et al. 2004; Jouenne et al. 2005). 이러한 결과는 부식 물질을 포함한 환경변화가 식물플랑크톤 변동 및 부유생태계에 미치는 영향을 정확하게 파악하기 위해서는 결국 식물플랑크톤의 생체량 뿐만 아니라 크기 구조에 대한 조사도 필요하다는 것을 보여준다.
본 연구를 통해 부식산이 식물플랑크톤의 생체량 증가에 기여한다는 것을 확인할 수 있었지만 식물플랑크톤이 직접 부식산을 흡수하는 것(Carlsson et al. 1999)인지 아니면 화학적 작용(Lee et al. 2009)이나 종속영양 박테리아의 분해와 같은 생물학적 작용(See et al. 2006)으로 생산되는 부산물로 인한 것인지는 확실하지 않다. 본 연구에서 조사한 질소와 인의 비(N:P ratio)를 보면 질소(N)가 잠재적으로 제한되었던 가을철을 제외하고 대부분 인(P)이 잠재적인 제한 영양물질로 확인되었다. 이러한 결과는 실질적인 제한 영양물질 파악을 위해 실시되었던 생물검정실험에서도 유사하게 나타났다(Yoon et al. 2023). 이렇게 수층에 영양물질이 부족할 시 여러 기능적 그룹과 분자적 구조를 가진 복합체인 부식물질이 수중에서의 생물학적 혹은 비생물학적 상호작용을 통해 영양물질의 재생산(Francko 1986; Steinberg 2003)에 기여할 가능성이 있다고 본다. 다만 식물플랑크톤에 의한 부식산 이용에 대해서는 안정동위원소 분석과 같은 추가적인 연구를 통해 정확한 기작을 파악할 필요가 있다.
5. 결 론
본 연구에서는 불규칙하게 담수가 유입되는 영산강 하구 해수역을 대상으로 메소코즘(mesocosm) 배양 실험을 계절별로 실시하여 난분해성 유기물로 알려진 부식산 첨가에 대한 식물플랑크톤의 반응을 크기별로 관찰하였다. 실험 결과, 부식산 첨가에 대한 식물플랑크톤의 반응은 계절에 따라 상이하였으나 하굿둑에서 지리적으로 먼 정점보다는 인접한 정점에서 그리고 크기가 큰 net-size보다는 작은 nano-size의 생체량이 유의하게 증가하는 것으로 나타났다. 이는 부식물질 첨가가 식물플랑크톤의 변동에 영향을 줄 수 있다는 기존의 가설과 반응의 크기별 특이성을 확인하는 결과라 할 수 있다. 특히 영산강 하구의 해수역에서는 인위적인 갑문 조작으로 인해 불규칙하고 간헐적으로 대량의 담수가 방류되면서 부식 물질과 같은 난분해성 유기물이 유입될 수 있고 담수역의 난분해성 유기물이 증가하고 있는 추세를 고려했을 때, 본 연구 결과는 영양물질과 더불어 이들 유기물의 거동에 대한 이해와 관리가 필요하다는 것을 제시하고 있다. 다만 부식산 첨가에 대한 크기별 반응 외에도 종별 반응에 대한 조사 그리고 식물플랑크톤이 어떠한 과정을 통해 부식산을 이용하는지에 대한 추가적인 연구 조사도 필요할 것으로 판단된다.