1. 서 론
2. 조류의 선체부착
선체부착 기작
선체부착생물의 국가간 이동
3. 선체부착 미세조류 연구방법 및 분류군 특성
현장 채집 및 조사방법
선체부착 미세조류 분석 방법
국내 부착 미세조류의 분류군 현황
4. 국내 부착 미세조류에 대한 생태학적 영향
부착 외래생물의 유입에 의한 생태계 교란
경제적 피해
5. 요약 및 결론
1. 서 론
인류의 해상 무역 활동은 산업화 이후 크게 증가하였고, 선박을 통한 해양 외래종의 확산을 야기하였다. 선박을 통한 해양 외래종의 이동은 선박 평형수(ballast water)와 선체 부착(hull fouling)으로 매개된다(Williams et al. 2013; 하와 박 2020). 선박 평형수는 해양 외래종 확산의 주요 원인으로 지적되어 집중적인 연구 및 관리 대상이었다(Lavoie et al. 1999; 유 등 2006; 박과 김 2010). 국제 해사기구(International Maritime Organization, IMO)는 2004년부터 선박 평형수 관리 협약을 채택하여 평형수를 통해 이동하는 해양 외래종들을 관리하기 시작하였다. 하지만 선체에 붙어 들어오는 외래종의 유입 가능성도 높은 것으로 보고되었다(Cranfield et al. 1998; Hewitt et al. 1999, 2004). 뉴질랜드에서는 선체 부착을 통해 유입되는 해양 외래종이 선박 평형수 보다 더 많았다(Cranfield et al. 1998). 해당 연구에의하면 해양 외래종의 약 20~30%가 선박평형수에 기인하고, 약 55~60%가 선체 부착을 통해 유입되는 것으로 알려졌다. 호주에서는 해양 외래종의 약 50~55%가 선체 부착으로 매개되고 있으며, 그 중 Phillip Bay조사에서 약 78%를 차지하였다(Hewitt et al. 1999, 2004). 이러한 연구들은 선체 부착이 해양 외래종 확산의 주요 유입 경로임을 시사한다. 따라서 해양생태계 보호에 있어 선체 부착 생물 관리는 중요한 대상으로 부각되고 있다.
IMO는 선체 매개 생물의 일관된 관리를 위해 2011년 해양환경보호위원회 회의에서 선체부착생물 이동 억제를 위한 가이드라인을 마련하였다. 해당 지침은 선체부착생물의 이동 저감을 위한 선박의 설계 및 건조, 방오(anti- fouling)장치 설치 및 방오도료 선정 기준, 선체부착생물 관리 항목, 선장 및 그 외 관리 인원들에 대한 주기적인 교육에 관한 내용을 담고 있다(IMO 2011). 다른 국제단체인 유엔개발계획(United Nations Development Programme, UNDP)과 지구환경기구(Global Environment Facility, GEF)에서는 선체부착 생물들의 유입과 전파를 막기 위해 GloFouling Project를 만들었다. GloFouling Project는 해상 무역량이 증가하는 브라질, 인도네시아와 같은 개발도상국에 경제적인 지원활동을 하여 해양 외래종의 확산을 막기 위한 참여를 유도하고 있다(IMO 2019). 협력국들은 이에 응하여 자국에 들어오는 외래 부착 해양 생물들을 조사하고 있다. 이러한 개발도상국에 대한 지원은 선체부착생물 문제가 이해 당사 국가의 협력이 필요한 전 세계적인 문제임을 의미한다.
이러한 세계적인 흐름에 호응하여 일부 국가들은 자체 제도를 통해 선체부착생물에 대한 관리를 이행하고 있다. 미국의 해양 경비대는 연방 규정에 의해 자국 수역에서 운항하는 선체부착 외래종을 제거하고 있다. 캘리포니아에서는 2017년 10월 1일 이후 항구에 입항하는 300톤 이상의 선박에 대해 주법에 따라 선체부착 외래생물 제거여부를 관리하고 있다(California SLC 2017). 뉴질랜드 1차 산업부가 2018년부터 시행한 CRMS-BIOFOUL 법은 영해 밖에서 들어와 정박하는 선박의 선체부착생물을 입항 전에 제거하도록 하고 있다(MPI 2018). 호주의 경우 IMO의 지침을 따르고 있으며, 현재 자체 지침을 만들어 선박들에게 자발적 이행을 권고하고 있다.
국내에서는 해양 외래종 규제를 위해 2014년부터 선박 평형수 관리법을 시행하고 있다. 선박 평형수 관리법은 2004년 IMO의 국제 협약을 토대로 만들어진 법안으로 평형수를 관리하는데 초점이 맞추어져 있다(두 2015). 하지만 최근 국제사회에서 중요한 문제인 선체부착생물에 대한 제도적 장치 및 관리는 부족하다. 이는 국내의 선체부착생물 관련 모니터링 연구나 데이터베이스 구축이 체계화되지 않았기 때문이다.
국내의 부착조류 관련 연구는 주로 자연기질을 대상으로 수행되었고, 아크릴판과 같은 인공기질 부착 실험이 일부 보고되었다(심과 정 1987; 강 등 1998; 심 등 1998; 위 등 2002; 백 등 2012). 이에 반해 선체부착조류 연구는 주로 선체부착생물의 부착방지 및 제거기술 개발, 관련 제도 정비 및 방오기술에 편중되어왔다. 또한, 선체 부착 생물 번식제어 장치 및 방오도료의 효율성 연구가 있다(김 2011; 신 등 2015). 이외에도 선체 부착 생물의 관리와 이에 대한 제거 기술개발(현 등 2018), 선박의 유속 변화에 의한 선체 부착생물 제거 효과를 수행한 연구가 있다(박 등 2018). 이러한 연구를 토대로 국내 관리 방안 및 정책적 규제안이 제안되어 왔다(석 2018; 하와 박 2020; 박 등 2020).
현재까지 선체부착 미세조류에 대한 종 분석과 분포 등에 관한 연구는 미흡하다. 국내에서 선체부착 미세조류 관련 연구가 부족한 것은 과학적인 연구방법이 확립되지 않았기 때문이다. 인공 부착 기질을 활용한 부착 미세조류 모니터링 기법 개발이 있지만, 실제 선체가 대상이 아니라는 점과 유류오염시 변화되는 부착 미세조류의 연구에 특화되어 실시되었다는 것이 한계로 지적된다(백 등 2012). 선체부착 미세조류의 채집 및 실험실 분석은 선체 표면에서 방출되는 방오도료의 영향으로 인해 수층에서 이루어지는 연구 방법을 적용하기 어렵다. 그럼에도 불구하고 외국은 선체 부착 미세조류에 대한 활발한 연구를 수행하고 있다(Hopkins and Forrest 2010; Leary et al. 2014; Azevedo et al. 2020). 뉴질랜드는 어선을 대상으로 선체 부착 미세조류 생물상을 파악하였고(Hopkins and Forrest 2010), 미국은 선박표면에 붙은 해양생물막에 서식하는 미세조류 군집구성을 조사하였다(Leary et al. 2014). 포르투갈은 항만에서 부착 미세 조류 생물상을 분자 생물학적인 방법으로 파악하였다(Azevedo et al. 2020). 이러한 연구들은 선체부착 미세조류가 전세계에 보편적으로 존재함을 의미한다. 따라서 국내 항만시설 및 항해하는 선박표면에서 다양한 부착 미세조류가 서식할 가능성이 있을 것으로 생각되며, 이에 대한 연구가 더욱 필요한 실정이다.
본 연구는 선체부착을 통해 유입 및 전파될 수 있는 미세조류의 현황을 연구하기위해 학술문헌을 바탕으로 국내에 서식하는 부착 미세조류의 분류군 현황을 조사하였으며 이를 기반으로 선체에 부착하는 미세조류의 과학적인 연구 방법을 제시하였다. 또한 선체부착 미세조류의 생태학적 영향에 대해 고찰하여 향후 연구 방향을 제시하였다.
2. 조류의 선체부착
선체부착 기작
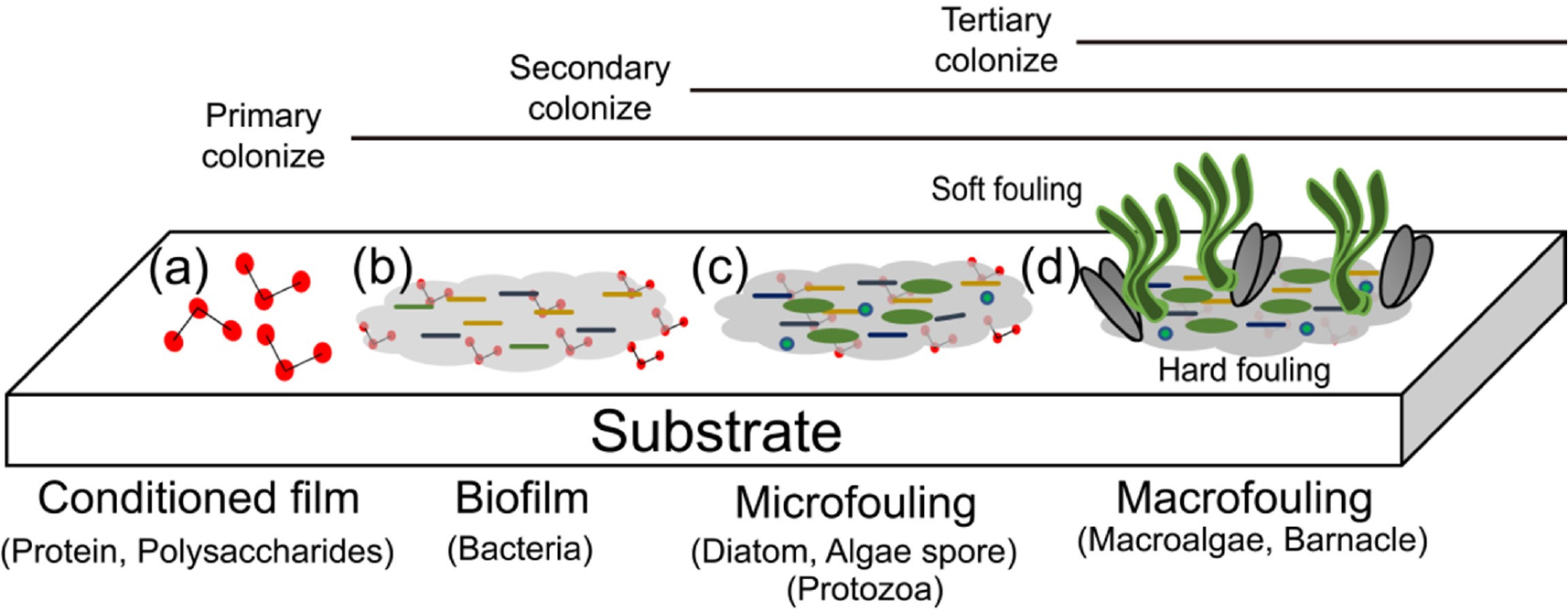
선체부착생물(hull fouling organism)은 해수에 잠기거나 노출된 선체에 부착할 수 있는 미생물, 미세조류, 원생동물, 해조류 그리고 무척추동물을 지칭한다(IMO 2011). 이들은 지속적인 부착을 통해 선체표면에 생물막을 형성하며, 미세 오손(microfouling)과 거대 오손(macrofouling)을 야기한다. 미세 오손은 생물막(biofilm)을 형성하는 박테리아 및 미세조류와 같은 크기가 작은 생물들이 부착된 상태이며, 거대 오손은 육안으로 식별 가능한 생물들이 부착한 상태이다. 거대 오손은 생물 종에 따라 두 가지 유형으로 구분된다. Soft fouling은 미역, 감태와 같은 해조류들이 주된 구성을 이루고 있을 때이다. Hard fouling은 따개비, 홍합 등 표면이 딱딱한 석회질 패각으로 둘러 싸인 생물들이 붙어 있을 때를 지칭한다(Callow and Callow 2002).
자연상태에서 생물들이 선체에 부착하여 성장하는데 몇 가지 과정을 거친다(Fig. 1). 초기에는 해수속의 다당류와 단백질 같은 용존 유기물(Dissolved Organic Matter, DOM)이 기질에 붙어 초기 막(conditioning film)을 형성한다(Meng et al. 2009). 이는 박테리아나 미세조류가 부착하기 위한 기질을 형성하는 역할을 한다. 이후 두번째 단계는 박테리아와 규조류들이 수초~수시간에 걸쳐 초기 막에 붙어 생물막을 형성해 1차 군집화에 접어든다. 세번째 단계는 미세조류, 해조류 포자, 원생동물들이 수일 동안 부착하여 2차 군집화로 미세 오손 상태가 된다. 이때 미세조류는 다당류로 이루어진 고분자성 물질(Extracellular Polymeric Substance, EPS)을 세포외벽에서 분비해 2차 군집화의 기초를 형성한다. 특히 규조류의 활강운동은 분비된 EPS를 이동시켜 생물막을 확장시키는 역할을 하여, 저서 생물의 부착 및 번식에 영향을 미치는 잠재적인 역할을 한다(Patil and Anil 2005). 생물막이 충분히 확장되면 수일 또는 수주에 걸쳐 해조류, 따개비와 같은 무척추동물이 추가적으로 붙어 거대 오손을 형성해 3차 군집화가 이루어진다(Callow and Callow 2002). 이러한 일련의 과정은 하위 단계와 상위 단계간의 긴밀한 상호작용의 결과로 모든 단계가 중요하다. 특히 다양한 부착 미세조류 중 규조류는 1차 군집 및 2차 군집화 형성에 매우 중요한 역할을 한다.
선체부착생물의 국가간 이동
선박 표면은 부착 미세조류가 부착할 수 있는 기질을 제공하며, 이들은 항해를 따라 대륙 간 이동이 가능하다. 생물들의 부착을 방지하기 위해 선박의 배관시설에 부착 방지 장치를 설치하고 선체 표면에 방오도료를 살포하기도 한다. 하지만 이러한 조치는 부착을 완전하게 막을 수 없으며, 결과적으로 부착생물들은 선박 계류 장치, 선체 표면과 같은 거의 모든 부분에 부착할 수 있다(Hewitt and Campbell 2010). 선박의 규모는 무역선, 컨테이너선, 여객선, 군함, 어선 등 매우 다양하다. 그 크기는 선체부착 미세조류가 부착할 수 있는 기질의 면적을 결정하기에, 선박에 따라 부착 미세조류의 부착량에 차이가 존재할 수 있다. 따라서 선체부착 미세조류 관리는 선박 크기 별로 세분화할 필요가 있다.
국제선은 환경이 상이한 서로 다른 해역 사이를 이동하기에 선체 부착생물의 다양성이 높아 집중적인 관리가 필요하다(Lebret et al. 2009). 한국은 세계의 다양한 국가와 교역을 하고 있으며, 유럽, 미주, 남미, 중동, 아프리카, 오세아니아 대륙 등 여러 국적의 선박이 국내로 입항한다(Fig. 2). 따라서 세계 각지로부터 외래 미세조류가 국내로 유입될 가능성이 높다. 우리나라에 유입할 수 있는 선체부착 미세조류의 주요 침입 경로로 유럽에서 대서양, 지중해, 인도양, 태평양을 거치는 경로가 있다. 그리고 미주와 남미에서 태평양을 거쳐 침입할 수도 있다. 선체부착 미세조류는 출발지에서 선체에 부착할 수 있으며 장거리 이동중에 끊임없이 탈락과 부착이 반복된다. 이때 이동거리가 길고 항해 속도가 느릴수록 선체부착생물의 부착 기회가 증가할 수 있다. 출발지에서 서식하고 있던 생물과 이동중에 부착한 생물들은 선박 도착지에서 탈락하여 외래종으로서 침입한다. 이러한 과정은 선박이 다른 항구로 이동할 때마다 반복될 수 있으며 외래종의 전세계적인 확산을 야기할 수 있다(Fig. 2b).
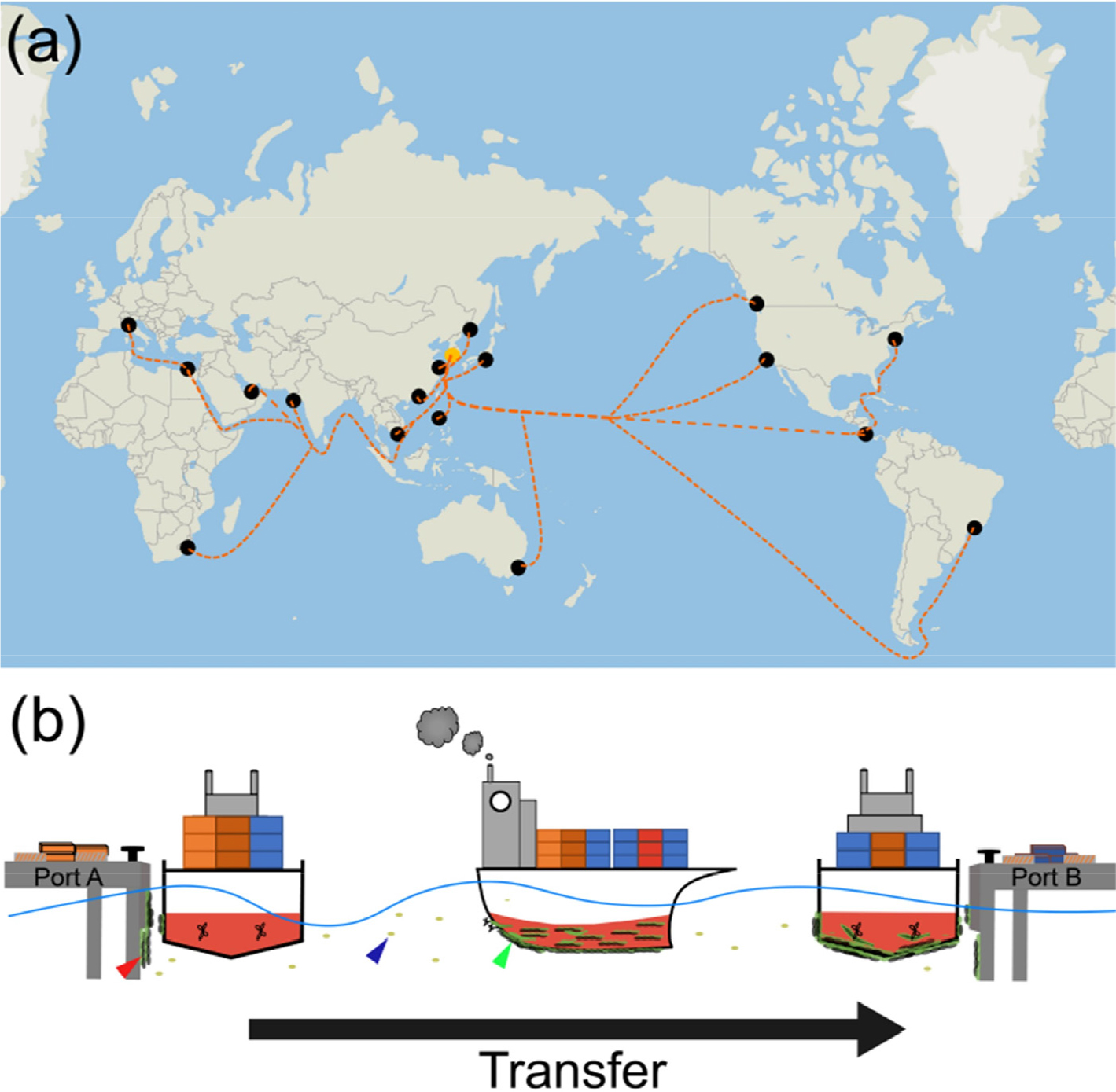
Fig. 2.
A map for main vessel operation routes between Korea and other countries (a) and transfer of microalgae from port A to port B by an international ship (b). (a) The movement routes of ships are marked with dotted orange lines connecting Korea (yellow dot) to other international ports (black dot). (b) While an international ship is anchored in port A, the algae attach to the hull, navigate the ocean, and then arrive at port B and transfer the attachment algae to the surrounding seawater. The red arrowhead represents microalgae, seaweed, and barnacles attached to the outer wall of the harbor; the blue arrowhead represents plankton and algae spores; the green arrowhead indicates hull-attached microalgae that transfer through voyages
3. 선체부착 미세조류 연구방법 및 분류군 특성
현장 채집 및 조사방법
일반적인 자연환경과 달리 선박은 이동하기 때문에 고정된 환경이 아니다. 따라서 다양한 환경에 노출될 수 있으며 선체부착 미세조류의 원서식지와 관련된 정확한 정보 취득이 어렵다. 이러한 한계를 보완하기 위해서는 선박의 제원 및 항해기록과 같은 정보를 확보할 필요가 있다. 출항지 및 도착지의 환경정보 및 체류시간 그리고 선박 이동경로와 항해 기간에 대한 정보는 선체부착 미세조류의 기원과 종의 특성을 분석하는데 필요한 기초적인 정보이다. 선체부착 미세조류의 종 분석 및 유입량을 조사하기 위해 채집 구역의 선정이 필수적이다. 이때 선박 표면의 전체 분석은 현실적으로 불가능하다. 또한 선박은 규모가 다양하기 때문에 일관적인 분석을 위해 선박의 종류와 상관없이 적용할 수 있는 방법이 필요하다. 예를 들어, 뉴질랜드 농림부 생물안전국(Ministry of Agriculture and Forestry Biosecurity New Zealand, MAFBNZ)에서는 선체를 수평적으로 선수, 선체 중앙, 선미로 구분한 뒤, 홀수선을 기준으로 세개의 수직층으로 구분한 27개의 채집구역을 제시하였다(MPI 2018).
선체부착조류의 현장 채집 방법은 수중 채집과 건식 도크(dry dock)채집으로 나뉜다(Fig. 3). 채집은 선체를 유지 보수하기 전인 입항 직후에 실시되어야 한다. 채집 현장의 수온, 염분, 용존 산소의 정보 취득은 선체 부착 미세조류의 적응 범위를 파악하기 위해 필요하다. 수중 채집은 물속에서 선체 표면을 페인트 긁개(paint scraper) 또는 솔(brush)로 긁어 탈락한 부산물을 포집하는 것이다. 이 방식은 원격 수중로봇(Remotely Operated underwater Vehicle, ROV) 또는 스쿠버 다이빙을 통해 가능하다. ROV는 수중에 있는 로봇을 이용하는 방법으로 로봇에 설치된 카메라를 통해 원격으로 조종하여 채집한다. 이는 사람이 직접 수중에서 채집을 하지 않고 기계를 이용하기 때문에 안전한 작업이 가능하다. 스쿠버 다이빙 방법은 사람이 직접 장비를 착용해 입수하여 채집한다. ROV와 달리 안전성 면에서는 위험할 수 있으나 일정한 크기의 격자를 부착하여 정량적으로 채집할 수 있다(Edmiston et al. 2021). 두 방법은 공통적으로 채집을 위해 로봇 운용 전문가, 스킨스쿠버와 같은 전문인력이 필요하다.
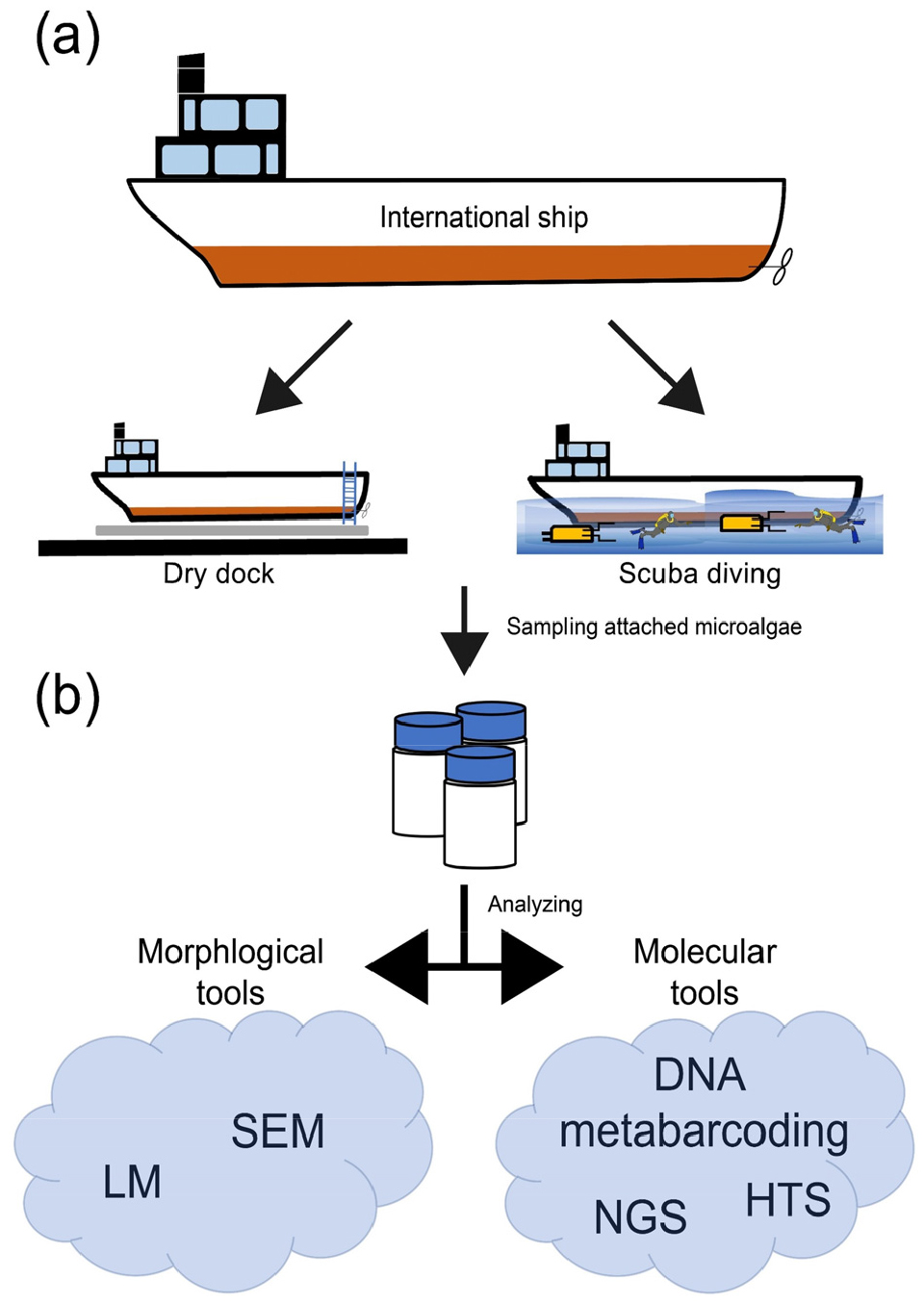
Fig. 3.
A schematic diagram for analyzing hull-attached microalgae. (a) Two sampling methods, such as drydock and remotely operated vehicle (ROV) or scuba in water. (b) The collected samples are analyzed with morphological (light and scanning electron microscope) and molecular tools (NGS, HTS and DNA metabarcoding)
수중 채집 시 선체 주변 해수로 인한 오염은 불가피하다. 이러한 오염은 주로 부유성 미세조류 및 자연기질로부터 떨어져 나온 토착 미세조류일 가능성이 높다. 채집시료에 따라 선체를 긁을 시 육안으로 확인할 수 있는 갈색 생물 막 또는 붉은색 방오도료 파편을 얻을 수 있다. 주변 해수로부터의 오염을 최소화하기 위해서는 이러한 시료를 현장에서 멸균해수로 세척하여 따로 분리할 필요가 있다. 이때 강한 세척은 시료로부터 부착 미세조류의 탈락을 유도함으로 적절한 조절이 필요하다. 하지만 이러한 조치가 오염을 완전히 막을 수 없기에, 채집한 선체 시료와 주변 해수 시료의 생물을 비교할 필요가 있다. 이때 보다 정확한 비교를 위해서 선박이 입항하기 전의 해수를 확보하는 것을 권장한다. 수중 채집 시 떨어져 나간 부유물은 주변해수로 유출되어 해양환경을 교란할 수 있기에 현장 채집에 적절한 장비가 고안되어야 할 것으로 생각된다(현 등 2018).
건식 도크(dry dock) 채집은 주변 해수와 격리되는 시설에서 선체 표면시료를 채집하는 방법이다. 건식 도크는 선박의 건조, 선체 청소 등의 유지보수를 위한 시설이다. 건식 도크에 격리된 선박은 선체 표면이 공기중에 노출된 상태로 해수와 접촉하지 않는다. 따라서 이 방법은 주변 해수로부터의 오염이 없이 선체에 붙어 있는 미세조류들을 조사할 수 있다. 이와 더불어 수중 채집에 비해 환경오염 문제에서 자유롭다. 하지만 선박의 예인 및 건식 도크의 유지 비용이 발생되며, 수중 채집 보다 시간적 비용이 더 소모될 수 있다(현 등 2018; Meloni et al. 2021).
선체부착 미세조류 분석 방법
선체부착 미세조류의 종조성 분석을 위해 형태학적 방법과 분자생물학적 방법이 사용된다(Fig. 3). 광학현미경(Light Microscope, LM)은 채집시료 내의 부착 미세조류 정량분석에 적합한 방법이다. 부착 미세조류 정량 시, 현장에서 고정한 시료를 사용하는 것이 바람직하다. 이때 시료 고정을 위해 루골용액, 포르말린, 글루타르알데히드와 같은 시약을 사용한다. 현미경으로 세포수를 정량 할 때 보편적으로 Sedgewick-Rafter counting chamber를 사용한다. 하지만, 부착 미세조류는 생물 막 또는 시료내의 파편에 부착한 상태로 채집됨으로 정확한 정량을 위해선 이를 균질화 해야 한다. 때문에 시료 분석 전에 초음파 분쇄기(sonicator)로 기질과 부착 미세조류를 분리하여 균질화 하는 것을 권장한다.
선체부착 미세조류는 크기가 작기 때문에 광학현미경으로 정확히 동정하기 어려운 경우가 있다. 주요한 선체부착 조류인 규조류는 세포벽인 frustule의 미세구조를 이용하여 종을 동정한다(Gaul et al. 1993). 남조류는 형태학적인 동정을 위해선 ultrastructure의 관찰이 필요하다(Komárek et al. 2014). 이러한 미세 구조들은 광학현미경으로는 분석하기 어려워 전자현미경이 필요하다. 20세기 중반에 등장한 전자현미경(Electron Microscope, EM)은 오늘날에 이르러 다양한 미세조류의 형태학적 분석에 사용되어지고 있다(Claugher 1990; Gaul et al. 1993). 국내 사례로 선체에서 분리한 매우 작은 부착규조류인 Amphora와 Navicula를 전계방사형 주사전자현미경(FE-SEM)을 활용하여 분석한 사례가 있다(박 등 2021). 선체부착 미세조류 조사 시 생물막이 발달하여 슬라임(slime)을 형성해 빛의 투과가 어려워 광학현미경 관찰이 어렵다. 주사전자현미경은 슬라임을 자연상태에 가까운 상태에서 분석할 수 있다(Callow 1986).
일부 조류는 정확한 동정을 위해서 분자생물학적 방법을 이용한다. 1950년대 DNA 이중나선의 발견 이후 1970년대 DNA 시퀀싱의 한 방법으로 Sanger 시퀀싱 방법이 개발되었다. 형태학적 방법을 이용한 종 동정은 숙련된 전문가가 필요하여, 기존 연구자들의 접근이 제한되어 왔다. 하지만 종이 가진 고유한 유전물질의 염기서열을 이용한 분자생물학적 동정은 간편하고 정확한 동정이 가능하다. 분자생물학적 방법은 환경에 존재하는 생물의 정량까지 가능한 수준으로 발전하였다. 최근에는 차세대유전체분석기법(Next-Generation Sequencing, NGS), 고처리량 시퀀싱(Higt-Throughput Sequence, HTS), 대규모 병렬 또는 심층 시퀀싱 방법이 활용되고 있다(Ebenezer et al. 2012). NGS, HTS와 같은 방법들은 기존 방법보다 빠르고 저렴하게, 동시에 여러 개의 시퀀싱을 수행할 수 있다. 염기서열 분석으로 환경 시료의 생물 군집조성을 파악하는 것을 메타게노믹스(Metagenomics) 또는 메타바코딩(Metabarcoding)이라고 하며, 본 방법은 환경 샘플에 존재하는 여러 종들의 염기서열 증폭량을 비교해 상대적인 정량이 가능하다. 대표적으로, 미군 함정을 대상으로 부착 생물막 군집을 메타게노믹스 방법으로 분석한 연구와 포르투갈 항구에서 오손 생물 군집을 메타 바코딩으로 분석한 연구가 있다(Leary et al. 2014; Azevedo et al. 2020). 메타바코딩 방식은 부착 생물 군집을 평가할 수 있고, 다양한 분류학적 정보를 제공하는 도구로서 사용되어진다(Azevedo et al. 2020). 이외에도 실시간 중합효소연쇄반응(real-time PCR)은 특정한 종만을 검출하여 정량 하는 방법으로 선체 부착 미세조류의 정확한 유입량을 조사하는데 활용될 수 있다(Ebenezer et al. 2012).
선체부착 미세조류의 생물양을 측정하는 방법으로 엽록소 a (Chlorophyll a) 농도 및 세포수를 측정할 수 있다. 하지만 실제 환경에서 선체부착조류의 엽록소 a 측정을 하기가 어렵다. 선체측면을 긁어 부착조류를 채집할 경우 선박 페인트 부스러기에 의해 오염될 수 있으며, 수중 채집의 경우 주변 해수에 존재하던 종들이 함께 포집되어 시료에 섞일 우려가 있기 때문이다. 이와 같은 오염을 방지하기 위해 부착 미세조류를 채집할 경우 공극 직경 200 μm 미만의 망목(mesh)을 사용하여 페인트 부스러기를 거른 후 시료를 수획하는 것을 권장한다. 또한 수중 채집의 경우 선박 표면 시료와 주변 해수를 동시에 채집하여 비교가 필요하다(Edmiston et al. 2021).
국내 부착 미세조류의 분류군 현황
국내 부착 미세조류 논문은 1987년에 처음 발표되었으며(심과 정 1987), 2021년까지 20 여편의 학술논문이 출간되었다. 연대별 기록으로 1990년대에 서해, 제주를 포함한 지역에서 해조류에 착생하는 미세조류의 분포가 조사되었다(이 등 1991; 김 등 1991; 유 등 1993; Chung and Choi 1999). 또한 인공부착판을 통해 부착 규조류와 부착성 박테리아의 상관성, 미세조류의 종 조성 및 천이현상이 조사되었다(심 등 1998; 강 등 1998). 2000년대에는 인공 기질을 통해 전복의 먹이 효율 및 성장률과 관련된 부착 미세조류의 활용 및 종 조성에 관한 연구가 진행되었다(위 등 2002; 백 등 2003). 부산 암반 조간대의 부착생물 군집연구에서 부착성 남조류가 보고되었고(유 2003), 해조류 착생 규조류의 다양성이 보고되었다(Chung and Lee 2008; 곽 2009). 2010년대에 잘피에 착생하는 규조류의 군집이 규명되었으며(정과 윤 2011), 해조류 착생 와편모조류 발굴 및 국내 분포가 기록되었다(백 2012a, 2012b; 김과 서 2019; Park et al. 2020). 또한 선박에 의한 유류오염사고시 환경 변화를 평가하는 지표로서 부착 미세조류를 활용한 모니터링기법이 개발되었다(백 등 2012).
해외에서는 선체부착 미세조류에 대한 다수의 연구 결과가 보고되었지만(Leary et al. 2014; Hunsucker and Swain 2016; Chen et al. 2019; Azevedo et al. 2020), 국내의 경우 연구가 거의 실시되지 않았다. 최근에 한국해양과학기술원 남해연구소의 연구조사선 장목 1호를 대상으로 선체 표면에 부착된 미세조류의 생물상이 처음으로 보고되었다(박 등 2021). 해당 연구에서 선체에 부착하는 미세조류로 Achnanthes brevipes, Licmophora sp.와 같은 저서성 돌말류 11종을 규명하였다. 이들은 크기가 20 µm 이하로 매우 작은 것이 특징이다. 또한 선체부착 미세조류는 수괴의 식물플랑크톤과 뚜렷이 다른 분류군으로 파악되었다.
자연환경에 존재하는 부착 미세조류는 잠재적으로 선체에 부착할 가능성이 있으며, 외래종을 판별하는 기준으로 활용될 수 있다. 따라서, 국내외 학술자료를 분석하여 국내해역에서 보고된 부착 미세조류의 분류군을 파악하였다. 종명은 Algaebase에 따라 파악하였으며(Guiry and Guiry 2022), 분류학적으로 불분명한 종은 분석에서 제외하였다. 또한, 기존 문헌에서 기재된 종 중 학명이 변경된 경우, 변경된 학명으로 기재하였다(Table 1). 그 결과 총 87속, 153종(spp. 제외)을 확인하였으며, 주요 미세조류는 규조류, 남조류, 와편모조류였다(Fig. 4). 세부적으로 규조류는 3 강(Class), 28 목(Order), 48 과(Family), 73 속(Genus), 143 종(Species) 이고, 남조류는 1 강, 4 목, 7 과, 10 속, 10 종이며, 와편모조류는 1강, 3 목, 3 과, 4 속 으로 파악되었다. 이러한 부착성 미세조류들은 국내의 다른 연구에서 부유성으로 보고된 사례가 있다(문과 최 2003). 이는 부착기질에서 탈락한 부착 미세조류가 해류에 의해 부유한 것으로 선체에 우연히 재부착 할 수 있다.
Table 1.
List of attachment microalgae taxa reported for 34 years in Korean sea
| TaxaSubstrate#, References& |
| 1. Phylum Bacillariophyta |
| 1.1. Class Bacillariophyceae |
| 1.1.1. Order Bacillariales |
| 1.1.1.1. Family Bacillariaceae |
| Bacillaria paxilliferaA,R,M,3,9,10,12,13 |
| Cylindrotheca closteriumA,R,M,1,3,5,6,7,8,9, C. gracilisR,M,3, C. spp.A,M,6,14 |
| Denticula spp.M,13 |
| Hantzschia marinaA,8, H. spectabilisM,13, H. virgataA,6 |
| Nitzschia bifurcataM,13, N. dissipataM,13, N. filiformisM,13, N. fonticolaM,13, N. frustulumA,M,2,6,13, N. gracilisM,13, N. hummiiR,M,3, N. laevissimaM,13, N. lanceolataR,M,3, N. longissimaA,M,6,7,10, N. obtusaM,13, N. paleaceaM,13, N. pusillaM,13, N. sigmaM,2, N. sigmoideaM,13, N. spp.A,R,M,2,3,6,8,13,14,18 |
| Psammodictyon panduriformeM,13 |
| Pseudo-nitzschia delicatissimaR,M,3, P. pungensA,5,6, P. pungens var. atlanticaR,M,3, P. seriataR,M,3 |
| Tryblionella apiculataM,13 |
| 1.1.2. Order Achnanthales |
| 1.1.2.1. Family Achnanthaceae |
| Achnanthes armillarisM,12,13, A. adnataR,M,3,13, A. brevipes var. angustataM,12,13, A. spp.A,M,6,12,13,18, A. subconstrictaR,M,2,3 |
| 1.1.2.2. Family Achnanthidiaceae |
| Achnanthidium maximumM,12, A. pusillumM,12,13 |
| Planothidium delicatulumM,12,13, P. hauckianumA,6 |
| 1.1.2.3. Family Cocconeidaceae |
| Campyloneis grevilleiR,M,3 |
| Cocconeis britannicaM,12, C. heteroideaM,7,12,13, C. molestaR,M,3, C. neothumensis var. marinaM,12, C. pellucidaR,M,3,12,13, C. placentulaA,R,M,3,6,7,12,13, C. pseudomarginataR,M,3,12,13, C. scutellumA,R,M,2,3,7,10,12,13, C. scutellum var. posidoniaeM,12,13, C. spp.A,M,2,3,12,13,14, C. stauroneiformisM,12,13, C. sublittoralisA,1 |
| 1.1.3. Order Cymbellales |
| 1.1.3.1. Family Anomoeoneidaceae |
| Anomoeoneis spp.M,12 |
| 1.1.3.2. Family Cymbellaceae |
| Brebissonia lanceolataM,3,12,13 |
| Cymbella affinisM,2, C. spp.M,2,12,13 |
| 1.1.3.3. Family Rhoicospheniaceae |
| Rhoicosphenia abbreviataR,M,3,12,13 |
| 1.1.3.4. Family Gomphonemataceae |
| Encyonema brehmiiM,12,13, E. gracileM,3,12,13 |
| Gomphonemopsis exiguaM,13 |
| 1.1.4. Order Eunotiales |
| 1.1.4.1. Family Eunotiaceae |
| Eunotia spp.M,12 |
| 1.1.5. Order Fragilariales |
| 1.1.5.1. Family Fragilariaceae |
| Fragilaria barbatulaM,12,13, F. hyalinaR,M,3,12,13, F. spp.R,M,2,3, F. striatulaM,2 |
| Synedra spp.A,R,M,2,3,14 |
| 1.1.5.2. Family Staurosiraceae |
| Pseudostaurosira brevistriataM,12, P. ellipticaM,13 |
| 1.1.6. Order Licmophorales |
| 1.1.6.1. Family Licmophoraceae |
| Licmophora abbreviataA,M,2,6, L. dalmaticaM,2, L. flabellataA,R,M,1,3,10, L. paradoxaA,6, L. spp.A,RM,2,9 |
| 1.1.6.2. Family Ulnariaceae |
| Tabularia barbatulaM,12,13, T. fasciculataR,M,3,12,13, T. parvaM,12,13, T. tabulataA,M,2,6, T. gailloniiA,1 |
| Ulnaria ulnaR,M,3 |
| 1.1.7. Order Lyrellales |
| 1.1.7.1. Family Lyrellaceae |
| Lyrella lyraA,R,3, L. spectabilisM,12,13 |
| 1.1.8. Order Mastogloiales |
| 1.1.8.1. Family Mastogloiaceae |
| Mastogloia pusillaM,12, M. smithiiM,12,13 |
| Tetramphora rhombicaR,M,3 |
| 1.1.9. Order Naviculales |
| 1.1.9.1. Family Amphipleuraceae |
| Amphipleura pellucidaM,12,13, A. rutilansM,7 |
| 1.1.9.2. Family Berkeleyaceae |
| Berkeleya rutilansM,12,13 |
| 1.1.9.3. Family Diadesmidaceae |
| Luticola muticaA,1 |
| 1.1.9.4. Family Diploneidaceae |
| Diploneis crabroM,12,13, D. ovalisM,12,13, D. splendidaR,M,3, D. spp.R,M,2,3 |
| 1.1.9.5. Family Naviculaceae |
| Haslea ostreariaM,12,13 |
| Navicula distansR,M,3, N. gregariaM,12,13, N. salinicolaA ,8, N. libellusR,M,3, N. parvulaA,6, N. perminutaM,12,13, N. radiosaM,12,13, N. ramosissimaM,12, N. spp.A,R,M,2,3,6,7,8,10,12,13,18 |
| 1.1.9.6. Family Pinnulariaceae |
| Pinnularia schroederiA,8, P. spp.R,M,2,3 |
| 1.1.9.7. Family Pleurosigmataceae |
| Pleurosigma elongatumR,M,3, P. normaniiA,9, P. spp.R,M,3 |
| Plagiotropis elegansR,M,3 |
| 1.1.10. Order Rhabdonematales |
| 1.1.10.1. Family Tabellariaceae |
| Asterionella formosaR,M,3, |
| Diatoma elongatumM,12 |
| 1.1.10.2. Family Grammatophoraceae |
| Grammatophora angulosaR,M,3, G. marinaA,R,M,3,6,12,13, G. oceanicaM,2,12,13, G. serpentinaR,M,3 |
| 1.1.10.3. Family Rhabdonemataceae |
| Delphineis surirellaM,12 |
| Rhabdonema adriaticumR,M,3,12,13, R. spp.M,8 |
| 1.1.11. Order Rhaphoneidales |
| 1.1.11.1. Family Asterionellopsidaceae |
| Asterionellopsis glacialisA,9 |
| 1.1.11.2. Family Rhaphoneidaceae |
| Rhaphoneis amphicerosR,2 |
| 1.1.12. Order Surirellales |
| 1.1.12.1. Family Auriculaceae |
| Auricula decipiensM,3 |
| 1.1.12.2. Family Entomoneidaceae |
| Entomoneis alataR,M,3, E. spp.A,9 |
| 1.1.12.3. Family Striatellaceae |
| Striatella unipunctataR,M,3 |
| 1.1.12.4. Family Surirellaceae |
| Campylodiscus adriaticusR,M,3 |
| Surirella minutaM,2 |
| 1.1.13. Order Thalassionematales |
| 1.1.13.1. Family Thalassionemataceae |
| Thalassionema frauenfeldiiR,M,3, T. nitzschioidesR,M,3, T. sppM,14 |
| 1.1.14. Order Thalassiophysales |
| 1.1.14.1. Family Catenulaceae |
| Amphora angustaR,M,3, A. arenariaR,M,3, A. coffeaeformisA,R,M,1,3,6, A. laevisR,M,3, A. libycaM,12, A. lineolataA,6, A. ovalisR,M,3,12,13, Amphora pediculusA,M, 6,12,13, A. quadrataR,M,3, A. spp.A,R,M,3,5,12 |
| Halamphora terrorisM,12, H. venetaA,8 |
| 1.1.14.2. Family Thalassiophysaceae, |
| Thalassiophysa hyalinaR,M,3 |
| 1.2. Class Coscinodiscophyceae |
| 1.2.1. Order Coscinodiscales |
| 1.2.1.1. Family Heliopeltaceae |
| Actinoptychus heliopeltaM,13, A. senariusM,2, A. splendensM,2 |
| 1.2.1.2. Family Coscinodiscaceae |
| Coscinodiscus angustelineatusR,2 |
| 1.2.2. Order Melosirales |
| 1.2.2.1. Family Melosiraceae |
| Melosira lineataM,2, M. moniliformisA,R,M,2,3,6, M. nummuloidesA,M,2,6 |
| 1.2.3. Order Stellarimales |
| 1.2.3.1. Family Trigoniaceae |
| Trigonium arcticumR,M,3 |
| 1.2.4. Order Stephanopyxales |
| 1.2.4.1. Family Stephanopyxidaceae |
| Stephanopyxis spp.A,9 |
| 1.2.5. Order Stictodiscales |
| 1.2.5.1. Family Stictodiscaceae |
| Arachnoidiscus ornatusR,M,3 |
| 1.3. Class Mediophyceae |
| 1.3.1. Order Chaetocerotales |
| 1.3.1.1. Family Chaetocerotaceae |
| Chaetoceros danicusM,2 |
| 1.3.1.2. Family Leptocylindraceae |
| Leptocylindrus danicusR,M,3 |
| 1.3.2. Order Eupodiscales |
| 1.3.2.1. Famliy Odontellaceae |
| Odontella auritaA,M,2,9 |
| 1.3.3. Order Hemiaulales |
| 1.3.3.1. Famliy Hemiaulaceae |
| Cerataulina spp.M,2 |
| 1.3.4. Order Lithodesmiales |
| 1.3.4.1. Famliy Lithodesmiaceae |
| Ditylum brightwelliiM,2 |
| Tropidoneis spp.R,M,3 |
| 1.3.5. Order Paraliales |
| 1.3.5.1. Family Paraliaceae |
| Paralia sulcataM,2 |
| 1.3.6. Order Rhizosoleniales |
| 1.3.6.1. Family Rhizosoleniaceae |
| Guinardia delicatulaR,M,3 |
| 1.3.7. Order Stephanodiscales |
| 1.3.7.1. Family Stephanodiscaceae |
| Cyclotella marinaM,13, C. balticaM,2 |
| 1.3.8. Order Thalassiosirales |
| 1.3.8.1. Family Skeletonemataceae |
| Skeletonema costatumM,13 |
| 1.3.8.2. Family Thalassiosiraceae |
| Thalassiosira eccentricaR,M,3, T. gravidaR,M,2,3, T. leptopusM,2 |
| 1.3.9. Order Toxariales |
| 1.3.9.1. Family Ardissoneaceae |
| Ardissonea fulgensR,M,3 |
| 2. Phylum Cyanobacteria |
| 2.1. Class Cyanophyceae |
| 2.1.1. Order Chroococcales |
| 2.1.1.1. Family Aphanothecaceae |
| Aphanothece spp.M,17, A. stagninaR,4 |
| 2.1.1.2. Family Entophysalidaceae |
| Entophysalis confertaM,R,4,11 |
| 2.1.1.3. Family Microcystaceae |
| Microcystis ichthyoblabeM,4 |
| 2.1.2. Order Oscillatoriales |
| 2.1.2.1. Family Oscillatoriaceae |
| Blennothrix glutinosaA,4 |
| Lyngbya confervoidesR,M,4, L. luteaR,11, L. majusculaR,M,4, L. spp.R, 7 |
| Oscillatoria spp.A,R,1,17 |
| Phormidium spp.A,1 |
| 2.1.2.2. Family Coleofasciculaceae |
| Anagnostidinema amphibiumR,11 |
| 2.1.3. Order Pleurocapsales |
| 2.1.3.1. Family Hyellaceae |
| Chamaecalyx leibleiniaeM,4 |
| 2.1.4. Order Synechococcales |
| 2.1.4.1. Family Leptolyngbyaceae |
| Leibleinia epiphyticaM,4 |
| 3. Phylum Miozoa |
| 3.1. Class Dinophyceae |
| 3.1.1. Order Amphidiniales |
| 3.1.1.1. Family Amphidiniaceae |
| Amphidinium spp.M,13,15 |
| 3.1.2. Order Gonyaulacales |
| 3.1.2.1. Family Pyrocystaceae |
| Gambierdiscus spp.M,13,15,16 |
| Ostreopsis spp.M,17,18,20 |
| 3.1.3. Order Prorocentrales |
| 3.1.3.1 Family Prorocentraceae |
| Prorocentrum spp.M,16,17 |
#Abbreviation: A, Artificial; R, rock (or bedrock); M, macroalgae. &Reference: 1, 심과 정 1987; 2, 김 등 1991; 3, 이 등 1991; 4, 유 등 1993; 5, 강 등 1998; 6, 심 등 1998; 7, Chung and Choi 1999; 8, 한과 허 2000; 9, 위 등 2002; 10, 백 등 2003; 11, 유 2003; 12, Chung and Lee 2008; 13, 곽 2009; 14, 정과 윤 2011; 15, 백 2012a; 16, 백 2012b; 17, 백 등 2012; 18, 김 등 2016; 19, 김과 서 2019; 20, Park et al. 2020
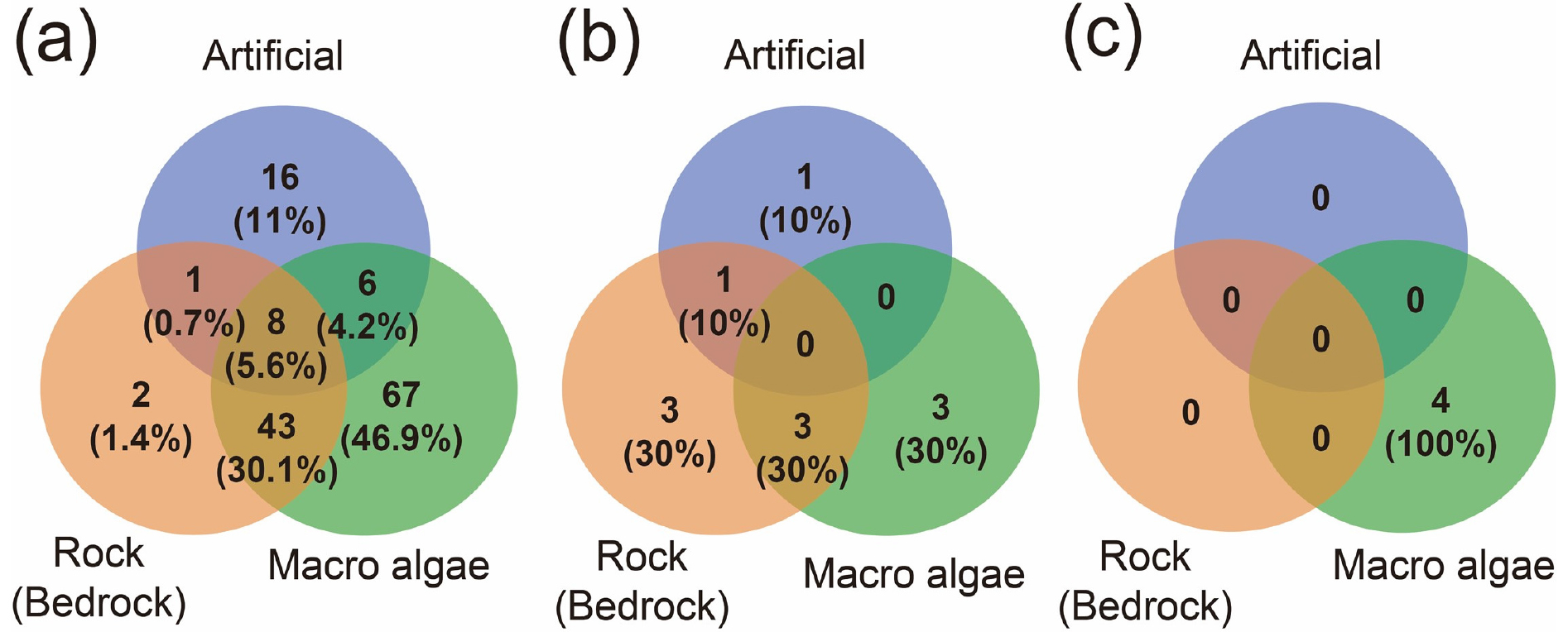
Fig. 4.
Ven diagrams for adherent microalgae taxa, diatoms (a), cyanobacteria (b) and dinoflagellates (c), detected on three different substrates (artificial materials, rocks, and macroalgae) identified from research data published over the past 30 years in Korea. Blue, red and green circles indicate artificial substrates (attachment plates), stone or bedrock substrates, and surface of seaweed, respectively. The numbers in the circle indicate the number of species recorded. The number in parentheses means the species composition ratio of attached microalgae
국내 서식 부착 미세조류는 대부분 규조류로 확인되었으며(전체의 93%), 이들은 다양한 기질에서 출현하였다. 이들이 보고된 기질은 잘피류, 미역과 같은 해조류, 암반, 항만내 플라스틱 또는 아크릴판과 같은 인공기질이었다(Table 1). 이들 자료를 기반으로 보편적으로(5곳 이상) 검출된 규조류는 Amphora, Achnanthes, Cocconeis, Fragilaria, Grammatophora, Licmophora, Navicula, Nitzschia였다. 이들은 Bacillariophyceae에 속하는 깃털형 규조류로 알려져 있다(Hasle et al. 1996). 또한 분석에 사용한 논문에서 가장 빈번하게 보고된 미세조류는 Navicula, Nitzschia, Cylindrotheca closterium이며, 7편 이상의 문헌에서 기록되었다(Table 1). 기록된 일부 부착 미세조류는 형태적으로 속 수준에서 분류되었으며, 종 수준에서 분류되지는 못하였다. 이들 중 출현빈도가 높았던 규조류는 세포에서 점액질을 분비하여 부착하는 특성이 있는 종이다. 남조류 중 가장 많은 종이 출현한 속은 Lyngbya였다. 국내에서 부착 상태로 출현이 보고된 와편모조류는 해양 생태계 및 인간에 해를 가할 수 있는 독성 종으로 구성되어 있었다(백 2012a, 2012b).
규조류 중 기질에 따른 출현비율은 해조류 옆체 부착이 46.9%로 가장 높았고, 암반과 해조류에 공통으로 서식하는 종 30.1%, 인공기질에서 출현한 종 11%순으로 집계되었다. 남조류는 해조류 옆체에서 30%, 암반기질 30%, 인공기질 10%로 보고되었다. 와편모조류는 해조류에만 착생하여 보고되었으며, 다른 기질에서는 연구되지 않았다. 조사된 기질 중 해조류는 가장 높은 출현비율을 가졌는데, 이는 해조류를 대상으로 한 연구가 다른 기질에 비해 많았기 때문으로 생각된다. 따라서 정확한 기질 선호도를 분석하기 위해 다양한 기질을 대상으로 한 현장 분석 및 부착 실험이 필요하다(Fig. 4).
외국에서 선체에 생물막을 형성하는 미세조류는 Achnanthes, Amphora, Craspedostauros, Cocconeis, Licmophora, Navicula, Nitzschia, Toxarium, Oscillatoria, Phormidium이 대표적이다(Lebret et al. 2009). 이러한 종 구성은 국내에 보고된 부착 미세조류와 비슷하다. 이중 Navicula는 절두체에서 점액질 성분이 나오는 종으로 선박에서 부착 미세조류로 흔하게 볼 수 있는 종으로 알려져 있다(Hunsucker and Swain 2016; Chen et al. 2019). 국내사례와 해외사례를 종합할 때, 규조류는 다른 미세조류 분류군 보다 선체에 붙어 서식할 가능성과 번식력이 높을 것으로 생각된다. 따라서 선체부착조류의 유입정도를 파악할 때 규조류 중심의 모니터링이 필요하다.
4. 국내 부착 미세조류에 대한 생태학적 영향
부착 외래생물의 유입에 의한 생태계 교란
선박에 생물막을 형성한 부착조류는 국내로 유입될 시 기존 생태계를 교란할 수 있다(Davidson et al. 2009). 규조류와 남조류는 직접적으로 생물막을 형성해 조류의 포자 및 무척추동물의 유입 및 번식에 영향을 미치므로 잠재적 교란 인자로 여겨진다. 일례로 IMO 지정 유해 생물인 미역(Undaria pinnatifida)의 포자는 선체 표면에서 미세조류가 형성한 생물막에 붙어 다른 지역으로 전파되고 있다(Mineur et al. 2007). 미역의 기원지는 북서 태평양이지만 선박을 매개로 지중해, 호주, 대서양 등지로 이동하여 빠른 번식력으로 기존 토착생물들의 고유한 서식지를 빼앗아 생태계 군집 변화를 초래하였다(South et al. 2017). 따라서 부착 미세조류는 다른 부착 외래종의 전파를 매개하기에 관리가 필요하다. 한편, 다른 지역에서 유입된 미세조류는 토착 미세조류와는 다른 환경 적응범위를 가질 수 있으며, 긴 기간동안 대규모의 적조를 형성할 가능성 있다(Kim et al. 2018). 선체에 부착한 저서성 와편모조류가 국내에 유입 되어 적조를 발생시킬 경우, 어류의 집단 폐사 가능성이 있다. Gambierdiscus sp., Prorocentrum lima, Coolia sp., Amphidinium sp.는 시구아 톡신(Ciguatoxin, CTX)을 발생시키는 유독성 저서 와편모조류이다(백 2012a). 시구아 톡신은 어류, 무척추동물들의 내장과 같은 부분에 축적되어 수산식품을 오염 시킬 수 있으며, 인간이 이를 섭취할 시 구토, 설사와 같은 증상이 나타날 수 있다(Roué et al. 2016).
선체부착 미세조류의 유입은 인간의 건강 및 생태계에 직간접적인 영향을 줄 수 있다. 때문에 향후 연구에선 독성 선체 부착 미세조류의 다양성 및 이들의 환경적응범위에 대한 집중적인 분석이 필요하다.
경제적 피해
선체부착 미세조류는 선박 및 양식장에 대해 다양한 방법으로 악영향을 줄 수 있다(Callow and Callow 2002). 선박 표면에 부착 및 성장하는 미세조류는 선체의 부식을 유발하고 방오도료의 성능을 악화시킨다(Flemming 2002). 선박과 해양 발전기의 열교환기에 부착 미세조류가 증식할 시 물의 흐름을 억제해 기기의 효율성은 저하된다(Flemming 2002; Lebret et al. 2009). 미세조류에 의한 생물막이 두꺼울수록 선체의 마찰 저항력이 증가하며 운행 속도가 감소한다. 이러한 상태에서 정상적인 운행속도를 유지하기 위해서는 기존 사용하던 연료 소모량의 최대 약 40%를 더 사용해야 한다(Characklis 1990; Schultz et al. 2011). 이는 경제적인 손실과 함께 온실기체(Greenhouse Gas, GHGs) 중 하나인 이산화탄소 배출량을 31%까지 높일 수 있다(Shevalkar et al. 2020).
미세조류는 해양 외래종의 부착을 매개해 양식장 그물, 부표와 같은 구조물의 무게를 증가시켜 유지비용을 증가시킨다. 해양 외래종이 양식장으로 유입되어 증가하는 경우 양식장 내 물 흐름이 제한된다. 갑작스럽게 증가한 미세조류로 인한 어장 내 산소고갈은 물고기의 집단 폐사를 유도하여 수산업 피해를 야기할 수 있다(Schultz et al. 2011). 지금까지 국내에서 선체부착 외래 미세조류 유입에 의한 피해 사례는 보고되지 않았다. 국제 무역의 증가와 국제선 물동량의 증가는 부착생물을 통한 외래종의 유입 가능성을 증가시키고 있으며 이들의 효과적인 모니터링과 관리가 필요하다.
5. 요약 및 결론
해상 교통량의 증가로 인해 전 세계적으로 선체 표면을 매개로 부착 해양 외래종의 비의도적 전파가 새로운 문제로 인식되고 있다. 이에 따라 국제기구에선 다양한 관리 방안들이 활발히 논의되고 있다. 하지만 국내의 경우 부착 외래생물에 대한 생각과 이들의 관리 필요성에 대한 인식이 부족한 실정이다. 미세조류는 선박 표면에 부착할 수 있어 선체 오손에 중요한 역할을 한다. 또한 이들은 항해를 통해 다양한 지역으로 전파될 수 있기에 부착 미세조류의 파악은 선박을 통한 국가간 이동확산을 규명하기 위해 필요하다. 국내 선박 및 국제선을 대상으로 한 선체부착 미세조류 분류군 파악은 외래생물유입 여부 판단을 위해 우선적으로 진행될 필요가 있다. 이를 위해서 본 연구에서는 선체부착 조류 연구 방법으로 국제선의 현장시료 채집, 현미경 분석, 그리고 분자 유전학적 분석방법을 제시하였다. 또한 기존 문헌들을 통해 선체에 부착할 가능성이 있는 토착 부착 미세조류를 조사하였다. 그 결과 국내 자생 부착 미세조류는 복수종(spp.)을 제외하여 총 87속 153종(규조류 143 종, 남조류 10 종, 와편모조류 4 속)으로 파악되었으며, 규조류가 93%로 대부분을 차지하였다. 이들 부착조류는 해조류와 암반과 같은 자연기질 연구를 통해 파악한 종이 대부분이며, 인공 부착판을 이용한 실험을 통해서도 일부 규명되었다. 이러한 정보는 선체부착 미세조류 연구에 필요한 기초적인 정보를 제공할 수 있을 것으로 기대된다. 국내에서 보고된 부착 미세조류 조사는 대부분 광학 현미경 및 주사전자 현미경을 통해 이루어졌으며 정량적인 연구는 거의 진행되지 않았다. 또한 국제선에 부착하여 국내로 유입되는 미세조류에 대한 정보는 없다. 앞으로의 연구는 정량적인 연구를 통해 선체를 통한 유입량을 판별할 필요가 있다.
종합적으로 현재 국내 선체 부착 미세조류 연구는 기초적인 단계로 우선 국내 정박 선체를 대상으로 한 꾸준한 모니터링이 필요하다. 이러한 연구는 국제선을 통한 외래종 유입 관련 연구에 활용이 가능하며, 선체부착조류의 위해성 평가 및 생태계 영향 조사를 위한 기초자료로서 사용될 수 있을 것이다.