1. 서 론
2. 재료 및 방법
시료 채집
환경요인 분석
저서와편모조류 정량/정성 분석 및 종다양성 지수(H’)
3. 결 과
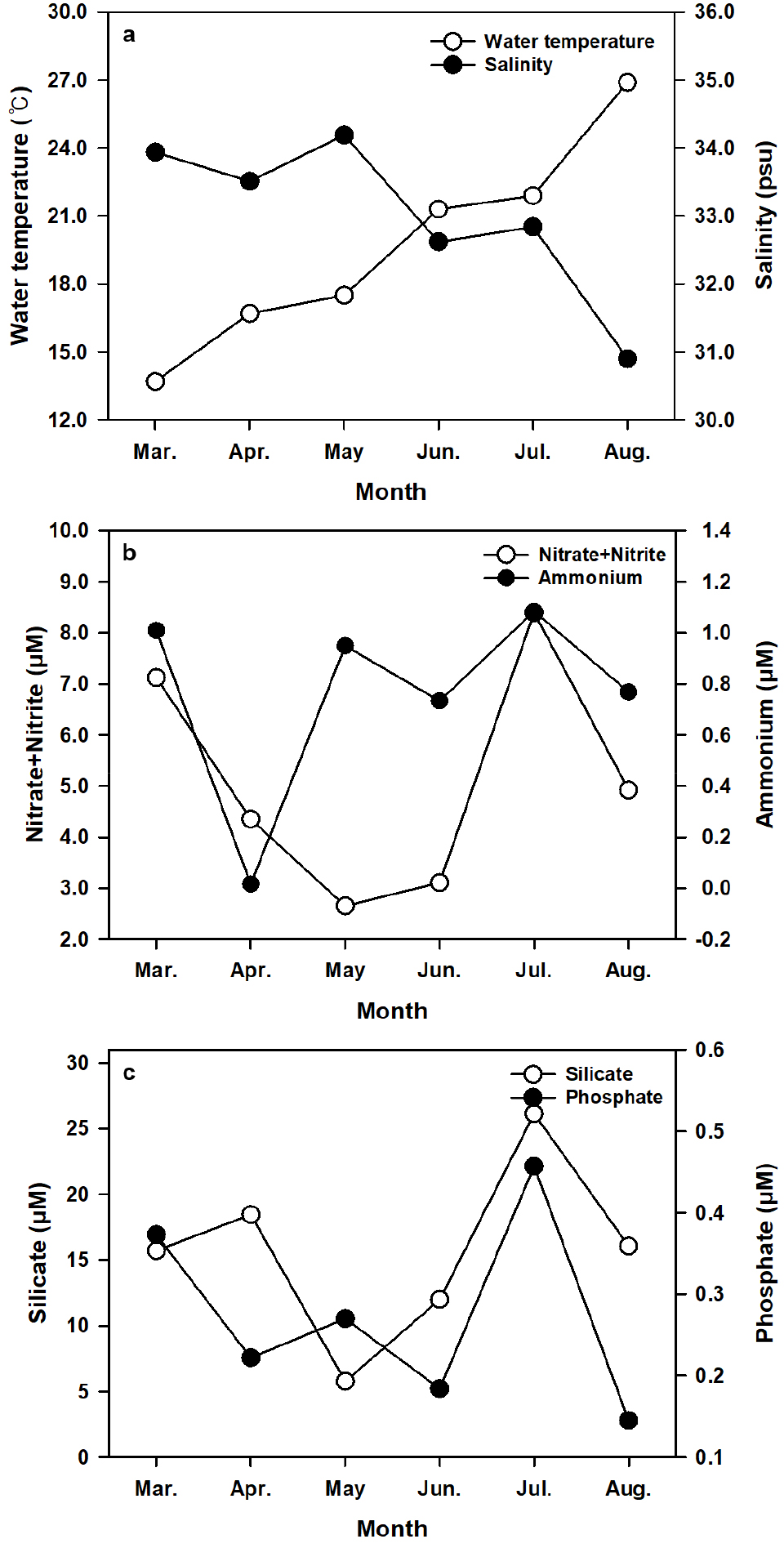
환경요인 변화
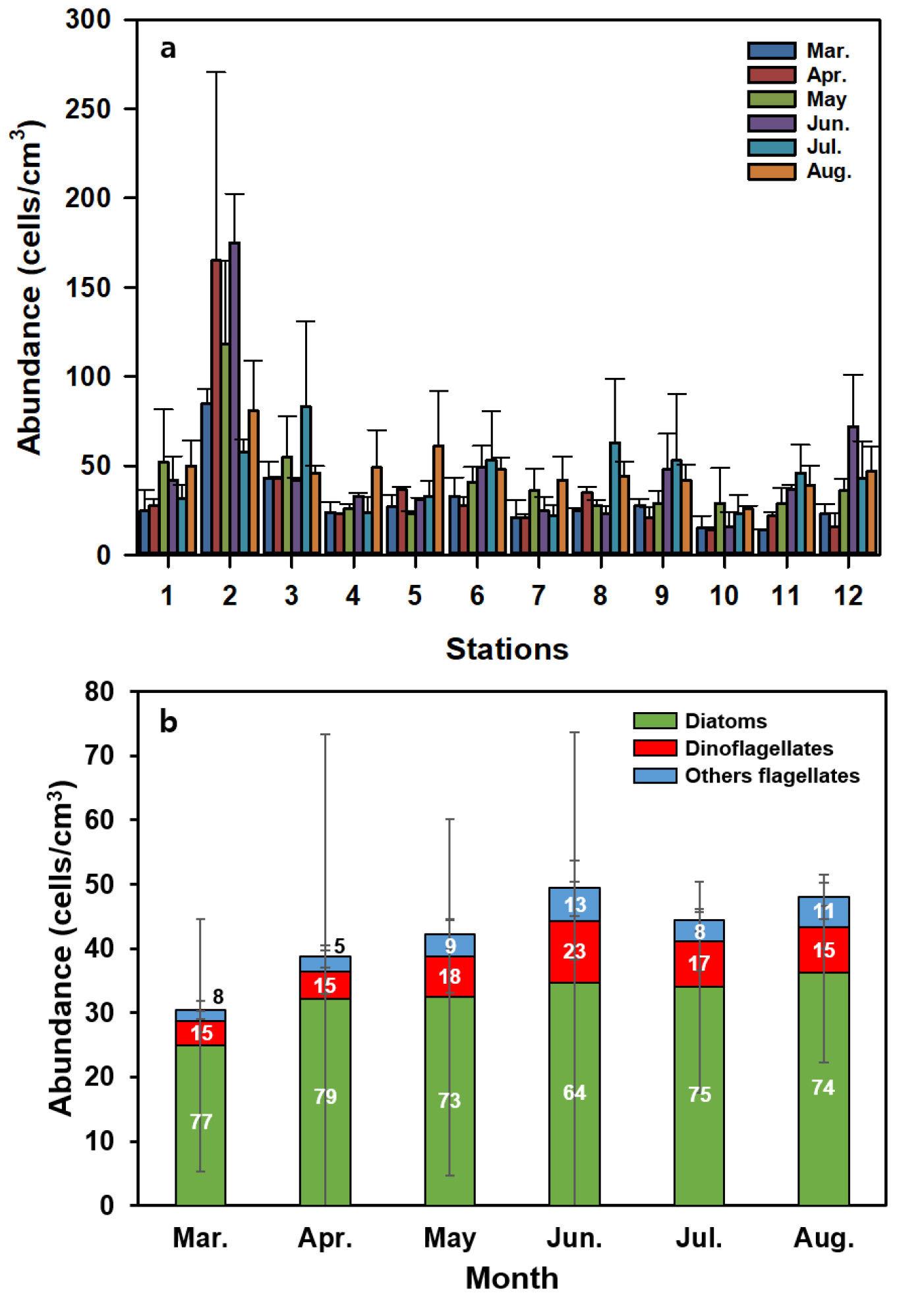
저서 미세조류 개체수 및 군집 변화
저서와편모조류 종다양성 및 출현종
4. 토 의
사질 조간대 서식처 환경과 저서 미세조류의 현존량
표선 사질 조간대의 저서와편모조류 종다양성
표선 조간대 사질 서식(sand-dwelling) 주요 출현 종
5. 요약 및 결론
1. 서 론
와편모조류는 해양생태계의 중요한 구성 요소 중 하나로 전세계적으로 약 3,500 종이 보고되었다(Guiry and Guiry 2024). 이들은 연안, 외해에 주로 서식하며, 독립영양, 혼합영양, 섭식영양 등 다양한 영양 방식을 통해 해양 먹이 그물망에서 중요한 역할을 수행한다(Dodge 1982; Tosteson et al. 1989; Jeong et al. 2010). 와편모조류 대부분은 부유성이지만, 일부 종은 다른 생물 또는 기질에 부착하거나 저서 환경에서 서식한다(Taylor et al. 2008; Kim et al. 2011b; Shah et al. 2014). 이러한 저서와편모조류 중 많은 종들이 산호나 해조류와 같은 생물에 부착하여 서식하는 부착와편모조류로 보고되었으나, 사질 조간대, 갯벌 등과 같은 퇴적물에서도 다양한 종들이 서식하는 것으로 보고되었다(Hoppenrath et al. 2014; 2023). 과거에는 저서와편모조류가 주로 열대 및 아열대 해역에서 보고되었지만(Fukuyo 1981; Besada et al. 1982; Morton and Faust 1997; Almazán-Becerril et al. 2015; Leung et al. 2018), 약 10년 전부터 온대 해역에서도 이들의 출현이 빈번히 보고되는 바, 이들의 서식 범위가 점차 확대되고 있는 것으로 추정된다(Pistocchi et al. 2011; Selina and Levchenko 2011; Shah et al. 2013). 저서와편모조류는 저서생태계에서 주요 1차생산자로써 매우 중요한 역할을 담당하나(Neves et al. 2017; Durán-Riveroll et al. 2019), 일부 저서와편모조류 종들은 ciguatoxin, palytoxin, amphidinols, okadic acid 등과 같은 신경 독소를 가지고 있는 것으로 알려져 있어(Yasumoto et al. 1987; Durán-Riveroll et al. 2019; Wang et al. 2022), 이들로 인한 보건적, 생태적 피해가 우려 된다. 따라서 이들에 대한 지속적인 관심이 요구되나, 상대적으로 저서 환경에 서식하고 있는 와편모조류의 분류 및 생태에 대한 연구는 미진한 편이다(Tester et al. 2020).
저서와편모조류에 대한 관심의 증대와 더불어, 사질 조간대에 서식하는 저서와편모조류의 종다양성 및 신속, 신종에 대한 보고가 지속적으로 이루어지고 있다(Watanabe et al. 2014; Pinto et al. 2017; Borchhardt et al. 2021; Luo et al. 2021). 국내에서 저서와편모조류에 대한 연구는 2011년부터 시작되었으며, 특히, 제주도 해역을 중심으로 수행되어 왔다(Kim et al. 2011b; Jeong et al. 2012a, 2012b; Kang et al. 2013; Lee et al. 2013; Lim et al. 2013; Shah et al. 2013; Jang et al. 2018; Kang and Lee 2018; 김과 서 2019; Lee and Park 2020; Park et al. 2021; Kang et al. 2022). 하지만, 저서와편모조류의 출현 및 분포 현황에 관한 연구는 주로 해조류 등의 부착성 종에 중점을 두어 수행되었으며(Kim et al. 2011b; 백 2012), 사질 조간대에 서식하는 저서와편모조류에 대한 연구는 약 10년전 Shah et al. (2014)와 김 등 (2015)의 연구에서만 수행되었다.
제주도는 한반도 최남단에 위치한 섬으로, 계절에 따라 대마난류, 제주난류, 양자강 유출수 등 다양한 수괴의 영향을 받는 지역이다. 또한, 2020년 보고에 따르면, 지구온난화의 영향으로 인해 지난 40년간 제주도 인근 해역의 연평균 해수온은 약 1.03°C 상승하였는데, 이는 전세계 연평균 해수온 상승치의 약 2.5 배에 달한다(Han and Lee 2020). 제주도 인근 해역은 이미 온대 해역에서 아열대 해역으로 변화함에 따라 국내 고유 생물종 서식지의 북방한계선이 북상하고 있으며, 아열대 및 열대 해양생물의 출현이 증가하는 등 제주도 해역의 생물상은 급변하고 있다(Denis et al. 2014; 고 등 2015; Park et al. 2020). 따라서, 본 연구는 제주 사질 조간대에 서식하는 저서와편모조류의 종다양성 및 출현 양상을 파악하기 위하여 2022년 춘계와 하계에 제주 표선 해변에서 조사를 수행하였다.
2. 재료 및 방법
시료 채집
제주 사질 조간대에 서식하는 저서와편모조류의 종다양성 및 출현 특성을 파악하기 위해, 2022년 3월부터 8월까지 매월 1회 제주 표선 해변 조간대에서 모래 시료를 채집하였다. 시료 채집을 위한 장소와 시기는 사전조사를 바탕으로 가장 다양한 저서와편모조류 종들의 출현이 확인된 장소와 시기를 고려하여 선정하였다(unpublished data). 표선 조간대는 가로 약 500 m, 세로 약 350 m의 넓은 면적을 가지고 있어, 조석 간만의 영향에 따른 저서와편모조류의 출현 영향을 고려하기 위해 조간대 전체 지역에 12개의 정점을 설정한 후, 정점 1에서 3은 조간대 상부, 정점 4에서 정점 9는 조간대 중부, 정점 10에서 정점 12를 조간대 하부로 구분하여 시료를 채집 및 분석하였다(Fig. 1). 시료는 각 정점에서 지름 4 cm, 길이 20 cm의 플라스틱 코어 샘플러를 사용하여 표면에서 5 cm 깊이까지의 모래를 채집하였다.
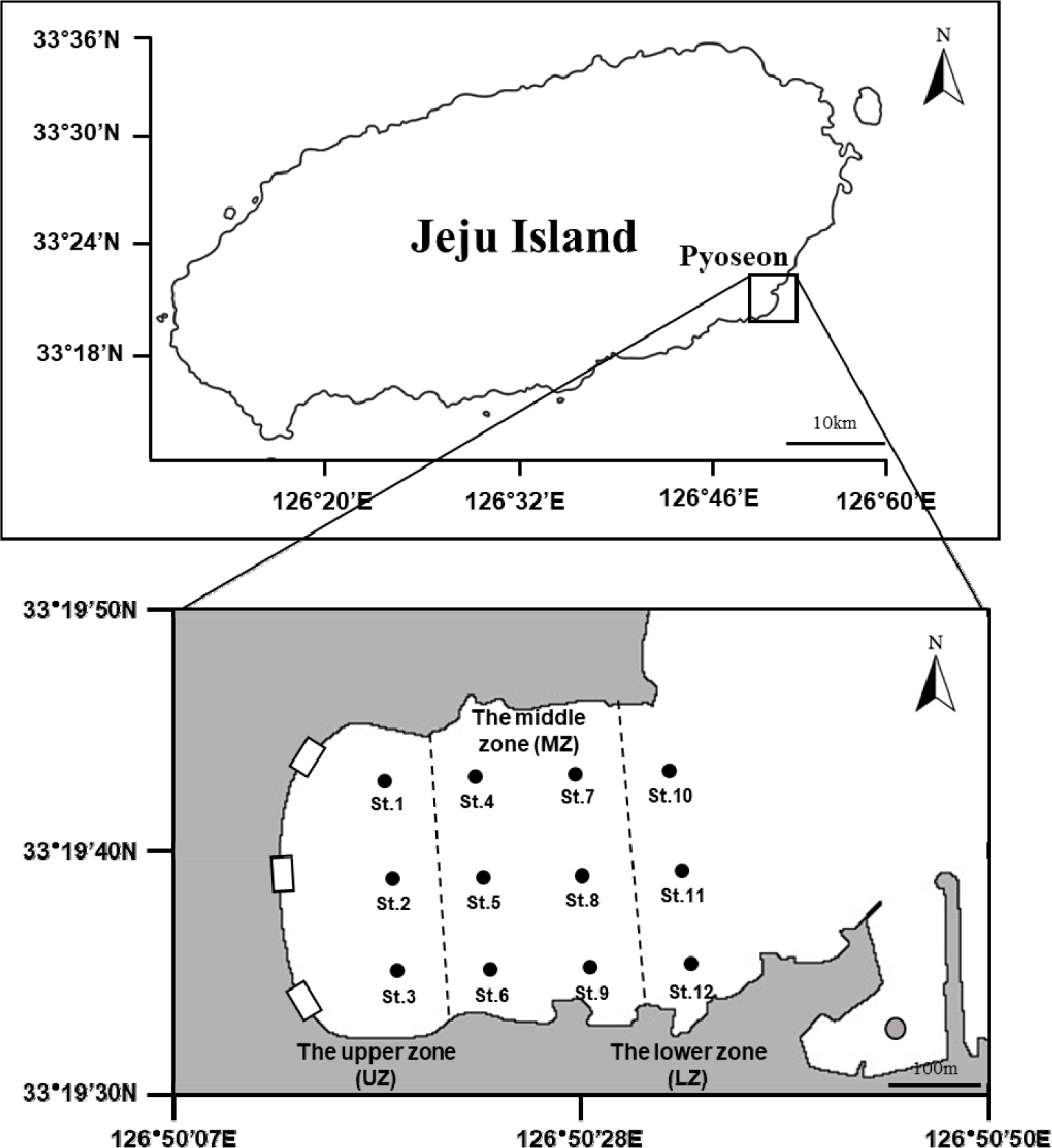
Fig. 1.
Sampling stations at Pyoseon Beach, Jeju Island. The three rectangles represent freshwater drains. UZ: St.1 to St.3, the upper intertidal zone. MZ: St.4 to St.9, the middle intertidal zone. LZ: St.10 to St.12, the lower intertidal zone. The gray circle indicates the locations where seawater temperature and salinity were measured
환경요인 분석
표선 해변 조간대의 인근 해역에서 해수의 수온과 염분을 다항목수질측정기(Professional Plus, YSI Inc., Ohio, USA)로 측정하였고, 추가로 정점 2 인근에 위치한 수로에서 유입되고 있는 담수 유출수(용천수 및 염지하수)의 염분을 염분측정기(S/Mill-E, Atago, Tokyo, Japan)로 측정하였다(Fig. 1). 영양염 분석을 위해, 조하대 부근에서 현장해수 100 mL를 채수하여 지름 47 mm의 GF/F 여과지(Glass Microfiber Filters, Whatman, Ireland)로 여과 후, 여과된 해수를 50 mL 용기(conical tube, SPL, Korea)에 담아 분석 전까지 영하 80°C에서 냉동 보관하였다. 영양염 농도를 측정하기 위해 냉동 보관된 시료를 실온에서 해동한 후, 자동 분석기(QuAAtro, SEAL Analytical, Germany)를 사용하여 Rho et al. (2015)에 분석 방법에 따라 질산염(NO3-; nitrate), 아질산염(NO2-; nitrite), 암모늄(NH4+; ammonium), 인산염(PO43-; phosphate), 규산염(Si(OH)4; silicate)의 농도를 측정하였다. 각각의 영양염 농도는 분석방법의 정확도와 정밀도를 확인하기 위하여 표준 물질(RMNS, KANSO Technos Co., Ltd., Japan Chemical Industries, Japan)을 사용하여 보정하였다(Rho et al. 2015). NOx (nitrate + nitrite)의 농도는 질산염과 아질산염 농도의 합으로 정의하였다.
저서와편모조류 정량/정성 분석 및 종다양성 지수(H’)
채집된 모래 시료에 여과해수 1 L를 추가한 후 100 μm 체에 걸러 큰 모래 입자 및 저서동물을 제거하였다. 여과된 시료 1 L를 빛이 통하지 않는 불투명한 광구병에 담고 Lugol 시약(Verlecar and Desai 2004)을 추가하여 최종 농도 1%가 되도록 고정하였다. 고정된 시료는 24시간 이상 정치시킨 후 상등액을 제거하여 최종 부피 100 mL가 되도록 10배 농축하였다. 저서와편모조류를 포함 총 저서 미세조류 정량 분석은 균질하게 혼합시킨 농축된 시료 중 1 mL를 Sedgwick-Rafter Chamber에 분주하여 광학현미경(BX50, Olympus, Tokyo, Japan) 200배율에서 계수하였고, 퇴적물의 단위 부피 당 세포 수(cells/ cm3)로 환산하였다. 저서와편모조류의 종 동정은 광학현미경 400–600배율에서 Hoppenrath et al. (2014, 2023)과 Dodge (1982)의 도감을 참고하여 수행하였고, 주요 종들의 세포형태를 ProgRes C3 카메라(Jenoptik, Jena, Germany)로 촬영하였다. 또한, 저서와편모조류 출현종 및 현존량 자료를 이용하여, 월별 각 정점의 종다양도 지수(H') 를 계산하였다(Shannon and Weiner 1963).
다양도 지수 :
Pi: i번째 종의 점유율
조간대 상부, 중부 그리고 하부 간의 저서와편모조류 종다양성의 유의차 검정을 위해 IBM SPSS statistics 26을 이용하여 일원 배치 분산 분석(one-way analysis of variance, one-way ANOVA)을 실시하였다(p < 0.05).
3. 결 과
환경요인 변화
조사기간 중 해수온의 범위는 13.7–26.9°C (평균 19.7 ± 4.7°C)로 관측되었으며, 3월이 13.7°C로 가장 낮고 8월이 26.9°C로 가장 높았으며, 3월에서 8월로 갈수록 점차 상승하였다(Fig. 2a). 염분의 범위는 30.9–34.2 psu (평균 33.0 ± 1.2 psu)로 관측되었고, 5월이 34.2 psu로 가장 높고 8월이 30.9 psu로 가장 낮았으며, 5월을 제외하고 3월에서 8월로 갈수록 점차 감소하는 경향을 보였다(Fig. 2a). 질산염 및 아질산염(NOx)의 농도 범위는 2.7–8.4 μM (평균 5.1 ± 2.3 μM)였고, 4월에 2.7 μM로 가장 낮고 7월에 8.4 μM로 가장 높았다(Fig. 2b). 암모늄 농도의 범위는 0.02–1.08 μM (평균 0.76 ± 0.39 μM)였고, 4월에 0.02 μM로 가장 낮고 7월에 1.08 μM로 가장 높았다(Fig. 2b). 규산염 농도의 범위는 5.77–26.14 μM (평균 15.69 ± 6.77 μM)로 5월에 5.77 μM로 가장 낮고 7월에 26.14 μM로 가장 높았다(Fig. 2b). 인산염 농도의 범위는 0.15–0.46 μM (평균 0.28 ± 0.12 μM)이고, 8월에 0.15 μM로 가장 낮고 7월에 0.46 μM로 가장 높았다(Fig. 2c). 암모늄은 3월부터 4월, 질산염 및 아질산염과 규산염은5월, 인산염은 6월까지 감소한 후, 7월에 모두 가장 높게 측정되었으며 8월에 다시 감소하는 경향을 보였다(Fig. 2b and c).
저서 미세조류 개체수 및 군집 변화
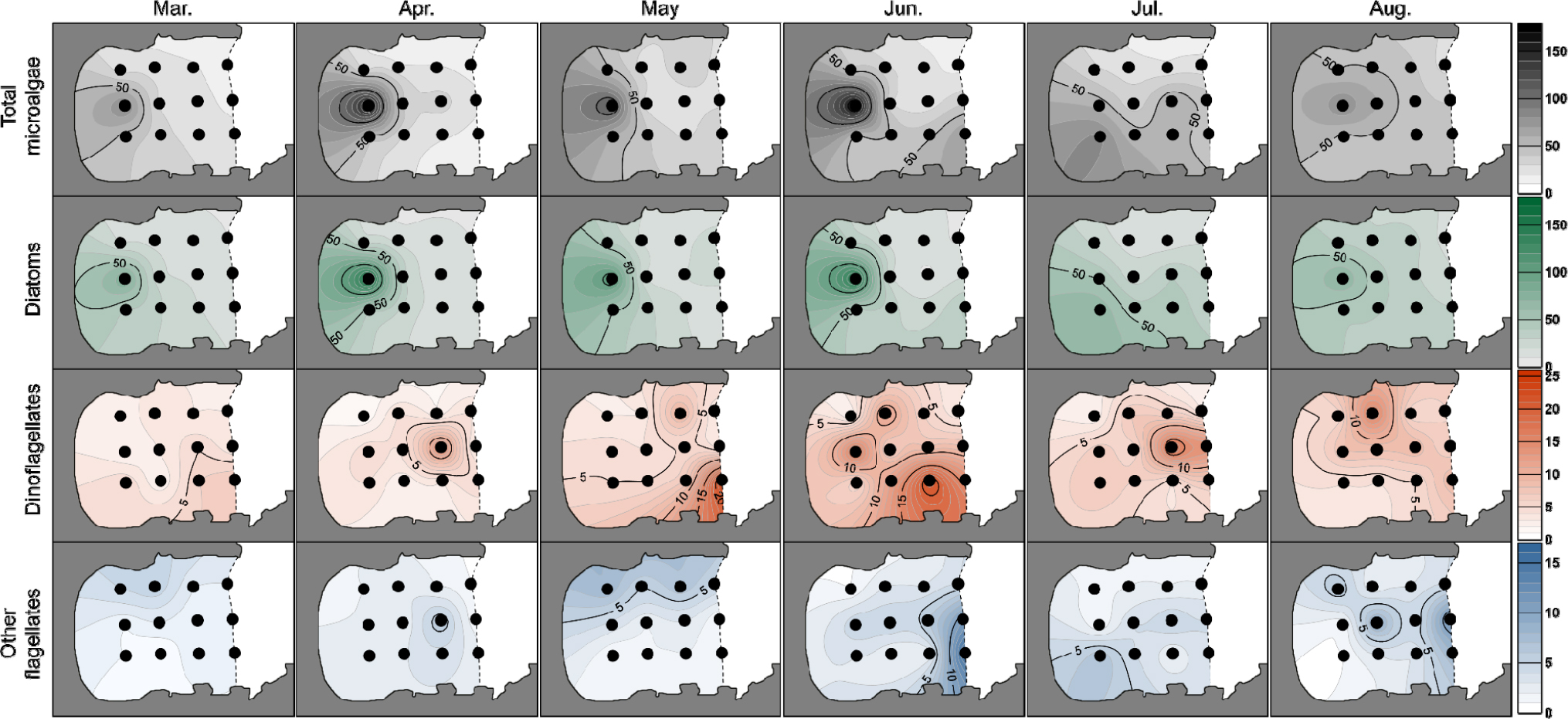
조사기간 동안 관찰된 총 저서 미세조류의 개체수는 14–175 cells/cm3의 세포밀도 범위로 관찰되었다(Fig. 3a). 정점별로는 7월을 제외하고 정점 2에서 저서 미세조류의 개체수가 가장 많았고, 7월에는 정점 3에서 개체수가 가장 많았다. 조사기간 중 6월, 정점2에서 175 cells/cm3로 가장 높은 세포밀도를 나타냈다. 12개 정점 총 저서 미세조류의 월별 평균 개체수는 31–49 cells/cm3의 세포밀도 범위로 관찰되었다. 개체수는 3월부터 점차 증가하여 6월에 최대 개체수를 나타낸 후, 8월까지 대체적으로 유지되었다. 저서 미세조류의 분류군별 출현 비율은 조사기간 내내 주로 깃돌말류(pennate diatom)인 저서 규조류(benthic diatom)가 64–79%의 비율로 우점하였으며, 저서와편모조류의 비율은 3, 4월에 15%로 가장 낮았고, 6월에 23%로 가장 높게 나타났다(Fig. 3b). 저서 규조류의 세포밀도는 9–160 cells/cm3의 범위로 관찰되었다. 정점별 분포는 7월을 제외한 조사기간 내내 정점 2에서 가장 높은 세포밀도를 나타내어, 조간대 하부에 비해 조간대 상부에 많이 분포하였다(Fig. 4). 저서와편모조류의 세포밀도는 1–23 cells/cm3의 범위로 6월에 가장 높았고, 조사기간 내내 대체적으로 조간대 중부지역에서 높은 세포밀도를 기록하였다(Fig. 4). 기타 편모조류의 세포밀도는 1–16 cells/cm3범위로 측정되었으며 하계로 갈수록 개체수가 증가하는 경향을 보였으나, 정점 위치에 따른 분포 경향은 파악되지 않았다(Fig. 4).
저서와편모조류 종다양성 및 출현종
사질 조간대에 서식하는 와편모조류의 종다양도 지수(H’)는 0.25–2.31(평균 1.48 ± 0.37) 범위를 보였다(Fig. 5). 월별 평균 다양도 지수는 상부 조간대보다 중부 혹은 하부 조간대에서 높게 나타났다. 통계적으로 조간대 상부, 중부, 하부의 평균 다양도 지수의 차이는 4월에서만 유의하였으나(ANOVA, p < 0.05), 6월과 8월을 제외하고는 상부 조간대부터 하부 조간대로 갈수록 종다양성 지수가 증가하는 경향을 보였다(Fig. 5).
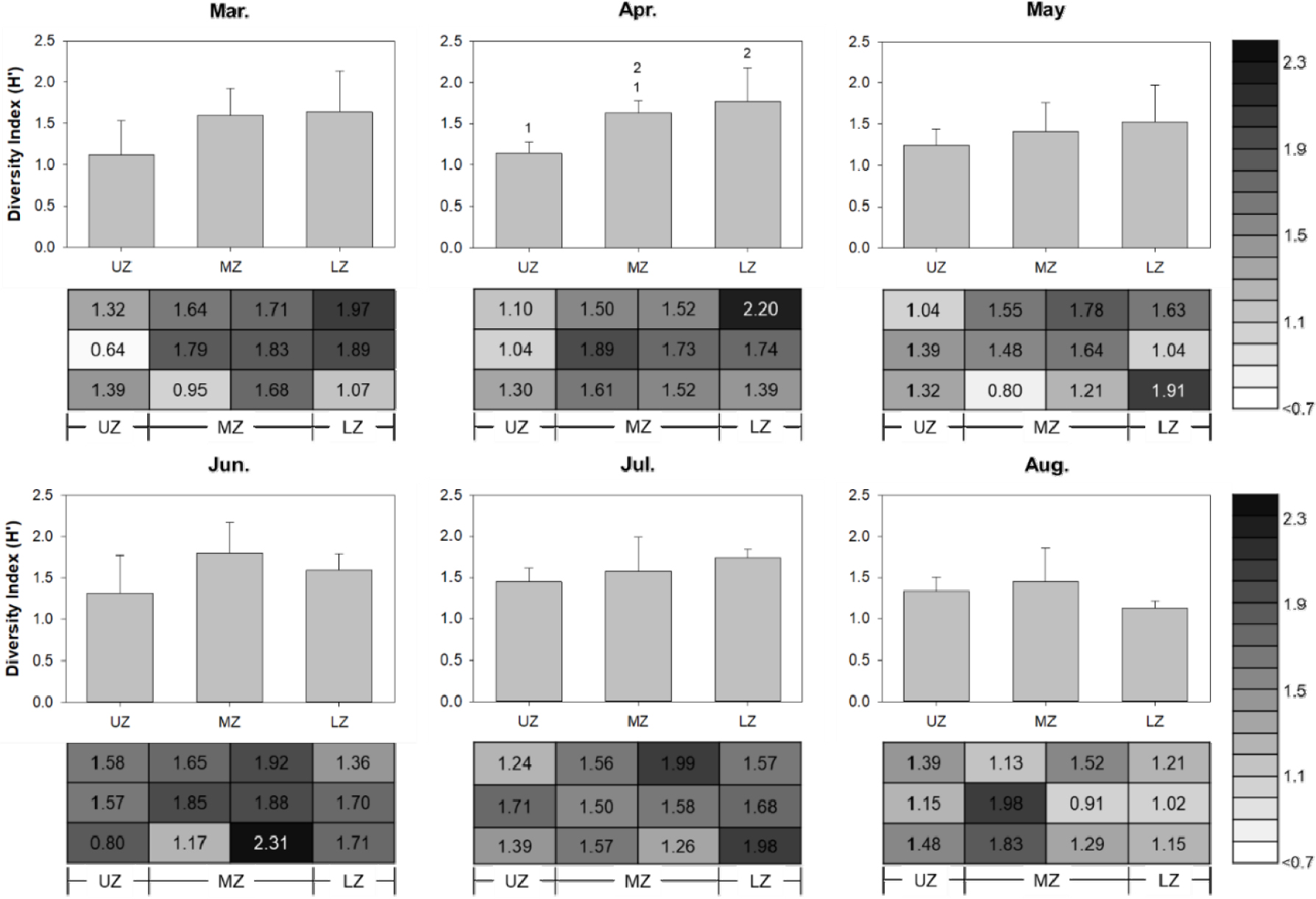
Fig. 5.
Monthly average of the diversity index (H') of sand-dwelling dinoflagellates in the upper (UZ), middle (MZ), and lower (LZ) zones, along with the diversity index for each station. The numbers in the bar graph (Apr.) indicate the differences between UZ and LZ as determined by ANOVA and Duncan's test. (p < 0.05)
조사기간 중 표선 해변에서 총 24속 50종의 저서와편모조류가 관찰되었다(Table 1, Fig. 6). 50종 중 잠재독성종 6종(Amphidinium carterae, A. gibbosum, A. massartii, A. operculatum, Prorocentrum concavum, P. rhathymum), 국내 미기록종 8종(Amphidiniopsis hexagona, Carinadinium striatum, Herdmania litoralis, Planodinium striatum, Psammodinium inclinatum, Sinophysis grandis, S. microcephala, S. minima)이 포함되었다. 조사기간 중 가장 다양한 종이 출현한 속은 Amphidinium으로 최소 10종 이상이 관찰되었고, 이어서 Prorocentrum 속 6종, Heterocapsa, Sinophysis, Testudodinium, Thecadinium이 각각 3종씩 관찰되었다(Table 1). 조사기간 중 매월 가장 빈번히 출현한 속은 Ampidinium, Apicoporus, Gymnodinium, Heterocapsa, Katodinium, Prorocentrum이었다. 특히, Heterocapsa속 종들은 대체적으로 높은 세포밀도를 나타내었는데, 그 중 H. psammophila는 5월에 13 cells/cm3로 가장 높았고, Heteropcaspa spp.는 11 cells/cm3로 8월에 가장 높은 세포밀도를 기록하였다. 잠재독성종으로 알려진 P. concavum은 4월과 6월에, A. carterae는 5월과 7월에 출현하였다. A. operculatum과 P. rhathymum은 수온이 21°C 이상인 하계에서만 관찰되었다. A. massartii는 5월을 제외하고 전 월 출현하였다.
Table 1.
Species list of sand-dwelling dinoflagellates found in Pyoseon Beach in this study
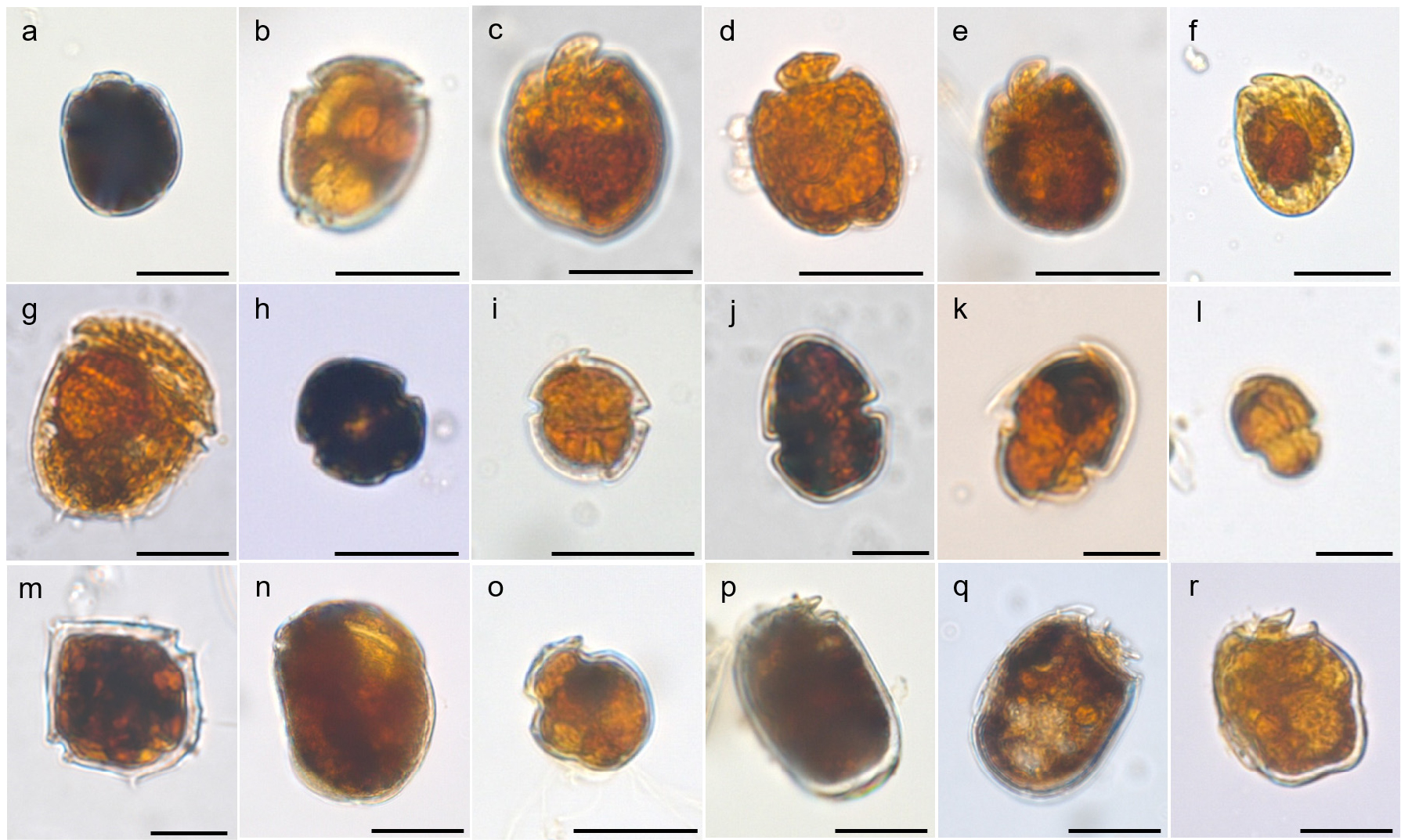
Fig. 6.
Light micrographs of sand-dwelling dinoflagellates found in this study. a. Adenois eludens; b. Amphidiniopsis hexagona; c. Amphidinium gibossum; d. Amphidinium herdmanii; e. Amphidinium operculatum; f. Amphidinium spp.; g. Carinadinium ovatum; h. Gymnodinium spp.; i. Herdmania litoralis; j. Heterocapsa psammophila; k. Katodinium asymmetricum; l. Katodinium var. asymmetricum; m. Protoperidinium spp.; n. Psammodinium inclinatum; o. Roscoffia sp.; p. Sinophysis grandis; q. Sinophysis microcephala; r. Sinophysis minima. Scale bars = 20 μm (a–j, n–r) and 10 μm (k–m)
4. 토 의
사질 조간대 서식처 환경과 저서 미세조류의 현존량
총 저서 미세조류의 12개 정점의 월별 평균 개체수는 하계로 갈수록 해수온이 증가함에 따라 증가하는 경향을 보였다(Figs. 2a and 3b). 총 저서 미세조류 개체수의 수온에 따른 증가 경향은 저서 규조류를 제외한 저서와편모조류와 기타 편모조류의 증가에 의한 결과였다(Table S1). 춘계에서 하계로의 계절 변화는 서식처 인근 해수온의 증가뿐만 아니라, 이들이 서식하고 있는 사질 퇴적물의 온도 또한 증가시킨다. 이전 연구들에 의하면 저서와편모조류들 중 Coolia malayensis는 최대 28°C, Ostreopsis ovata는 30°C, Prorocentrum lima는 30°C 등 비교적 높은 수온에서도 최적 성장을 할 수 있는 것으로 보고되었기에(Graneli et al. 2011; Aquino-Cruz et al. 2018; Li et al. 2020), 온대해역에서 계절의 변화에 따른 서식처 환경의 온도 증가는 저서와편모조류 종들의 개체수 증가와 밀접한 연관성이 있을 것으로 판단된다. 과거 사질 조간대에서 수행되었던 연구들에서도 해수온의 상승이 이들의 종다양성 및 개체수 증가에 중요한 변수로 작용한다는 점이 언급한 바 있다(Shah et al. 2014; 김 등 2015). 조사 기간 동안 낮은 염분과 저서와편모조류 및 기타 편모조류의 현존량 사이에 역상관성 또한 나타났으나(Table S1), 이는 하계에 표선 연안이 저염분 수괴의 영향을 받았기 때문으로, 염분의 감소와 저서와편모조류의 개체수 간의 직접적인 연관성을 설명하기는 어렵다. 2022년 하계 제주연안은 양자강 희석수의 영향으로 7월 이후 해수의 염도가 31 psu이하로 급격히 낮아졌다(장 등 2024). 하지만, 조사기간 내내 조간대 상부에 위치한 정점 2에서 눈에 띌 정도의 높은 저서 미세조류의 현존량이 관찰되었는데, 이는 정점 2 인근에 위치한 수로에서 공급되는 담수 유출수(용천수 및 염지하수)의 영향으로 사료된다. 각 조사 시기마다 정점 2 부근의 퇴적물은 조간대 상부지역임에도 불구하고 유입되는 담수유출수의 영향으로 높은 함수율을 유지하였다(data not shown). 각 조사 시기마다 추가로 측정했던 담수 유출수의 염분은 조사지역 인근 해수의 염분보다 0.94–4.84 psu 낮은 것이 확인되었다(Fig. S1). 제주의 용천수 및 염지하수는 높은 용존 질산염, 인산염 및 규산염 농도를 함유하고 있는 것으로 보고되고 있으며, 이는 인근 연안생태계의 일차생산력의 증가와 밀접한 연관이 있다고 보고된 바 있다(Kim et al. 2011a). 따라서, 정점 2로 지속 유입된 담수 유출수에 포함된 풍부한 영양염이 이 곳의 저서 미세조류의 개체수를 증가시켰을 것으로 사료된다. 하지만, 본 연구에서는 저서 미세조류의 개체수와 인근 해수의 영양염 농도들 간의 유의한 상관성은 나타내지 않았다(Table S1). 조사 기간 동안 표선 해변의 사질 조간대 12개 정점 중 저서규조류의 개체수가 높은 곳에서는 저서와편모조류의 출현밀도가 상대적으로 낮게 나타났다(Fig. 4). 특히, 조간대 상부에서는 저서규조류의 높은 개체수로 인해 저서와편모조류의 밀도가 매우 낮았으며, 상대적으로 조간대 상부에 비해 조간대 중하부의 저서와편모조류의 개체수가 더 높게 관찰되었다. 또한, 6월에는 수온이 높고 염분과 영양염이 낮은 환경 조건에서, 다른 월과 비교하여 저서 와편모조류의 개체수가 상대적으로 증가한 것이 확인되었다(Fig. 4). 해조류에 부착하는 부착 저서 와편모조류의 경우, Nakada et al. (2018)은 저서 규조류 밀도에 따라 부착 저서 와편모조류의 개체수가 증가하거나 감소할 수 있다고 보고한 바 있다. 해양에서도 규조류는 상대적으로 다른 식물플랑크톤 분류군에 비해 성장속도가 빠르며, 이에 따라 와편모조류는 규조류와의 경쟁에서 밀려나 상대적으로 낮은 영양염농도와 염분, 하계의 높은 수온에서 우점하는 경향을 보였다(Egge and Aksnes 1992; Ke et al. 2014; Jiang et al. 2019). 본 연구에서도 사질 조간대에서도 비슷한 양상이 관찰되었다.
따라서, 저서 미세조류의 현존량과 환경요인 간의 면밀한 분석을 위해서는, 서식처인 퇴적물의 온도, 함수율, 공극수 및 담수유입수의 영양염 농도, 퇴적물에 공존하는 포식자, 그리고 혼합 영양생물(mixotroph)이 대부분인 저서와편모조류의 경우, 박테리아 등의 먹이생물의 유무 등 다양한 물리·화학·생물학적 요인이 함께 고려되어야 할 것으로 사료된다.
표선 사질 조간대의 저서와편모조류 종다양성
일반적으로 조간대 저서생물의 분포는 해수온, 염분과 같은 일반적 물리 · 화학적 해양환경 요인뿐만 아니라, 조석에 따른 서식처의 공기 중 노출 시간, 파랑, 함수율 등 복잡하고 다변하는 각종 환경 요인에 크게 영향을 받는다. 조간대 상부는 하부에 비해 온도, 습도, 염분 등 환경 요인의 변폭이 크기 때문에, 이러한 스트레스에 적응할 수 있는 소수의 종만이 서식할 수 있는 반면, 하부로 갈수록 환경 적응에 따른 스트레스가 감소함에 따라 서식 가능한 종의 수가 증가하여 생물 간 경쟁 및 포식 압력이 증가한다(Castro and Huber 2019). 본 조사에서 표선 사질 조간대에서 관찰된 저서와편모조류 역시 조간대 상부보다 중부 및 하부에서 더 많은 개체수가 확인되었으며, 5월과 8월을 제외한 모든 시기에 하부로 갈수록 종다양도 지수(H’)가 평균적으로 증가하는 경향을 보였다. 하지만, 8월에는 조간대 하부에서 저서와편모조류의 종 다양성이 상부보다 낮게 측정되었는데, 이는 해당 시기 조간대 하부에서 Heterocapsa spp.가 비교적 높은 개체수로 우점했기 때문이었다. 조사 기간 동안 저서와편모조류의 종다양도 지수(H’) 값은 0.25–2.31의 범위로 측정되었는데 총 현존량이 증가함에 따라 다양성지수도 유의하게 증가하는 경향을 나타냈다(p < 0.05). 조사 기간 중 관찰된 저서와편모조류의 현존량은 1–23 cells/cm3의 범위였으며, 비교적 하계에 높은 세포밀도가 기록되었다.
조사 기간 동안 표선 사질 조간대에서 관찰된 저서와편모조류는 총 24속 50종으로 비교적 다양한 종이 출현하였다. 과거 국내 사질 조간대에 서식하는 저서와편모조류에 대한 연구는 Shah et al. (2014)와 김 등 (2015)에 의해서만 수행되었다. 제주에서의 연구는 Shah et al. (2014)에 의해 2011년 3월부터 2012년 2월까지 1년 간 제주 8 개 해변에서 수행되었으며, 해당 연구에서 8속 37종의 저서와편모조류 및 부착와편모조류가 보고되었다. 이 중 26종은 사질 퇴적물에서만 출현하였고, Amphidinium gibbosum, A. operculatum, Prorocentrum fukuyoi, P. rhathymum 4종은 사질 퇴적물과 해조류에서 모두 발견되었다. 당시 표선 조간대에서 발견된 저서와편모조류는 총 15종으로, Amphidiniopsis, Amphidinium, Cabra, Coolia, Durinskia, Heterocapsa, Oxyrrhis, Polykrikos, Prorocentrum, Thecadinium 9개 속이 보고되었다(Shah et al. 2014). 약 10년 이후 수행된 본 연구에서 Ankistrodinium, Apicoporus, Bysmastrum, Gymnodinium, Gyrodinium, Planodinium, Protoperidinium, Roscoffia, Sinophysis, Testudodinium, Togula 속이 추가로 출현하는 것을 확인할 수 있었다. 특히, Planodinium striatum, Sinophysis grandis, S. microcephala, S. minima 종들은 국내 미기록종으로 확인되었다. 이 중 Planodinium striatum은 영국, 독일, 이탈리아, 러시아 캐나다 등의 온대 해역에 광범위하게 분포하고 있는 것으로 알려진 종이다(Saunders and Dodge 1984; Hoppenrath et al. 2014). Sinophysis 속의 S. grandis, S. micorocephala 종들은 온대 해역 뿐만 아니라 열대해역에도 광범위하게 분포하는 종으로(Hoppenrath 2000; Diniz et al. 2017), 표선 조간대에서는 조사기간 동안 매우 빈번하게 관찰이 되었다. S. minima의 경우, 2001년 5월부터 9월까지 러시아 피오르트대제만에서 비교적 낮은 수온에서 출현이 보고되었지만 제주 표선에서는 7월을 제외한 모든 월에서 출현하였다(Selina and Hoppenrath 2004). 2011년 조사 당시 표선 인근 하계의 해수 온도는 약 21–25°C 로 본 연구보다 약 1–3°C가량 낮았다. 2012년부터 11월부터 2014년 2월까지 동호 사질 조간대에서 수행되었던 연구에서는 총 13속 27종의 저서와편모조류 종들이 출현하였는데, 이는 본 연구를 통해 관찰된 종 수의 약 절반이었으며, Amphidinium glabrum, A. latum, A. mootonorum, A. poecilochroum, Durinskia baltica, Gymnodinium myriopyrenoides, Polykrikos lebourae, Prorocentrum fukuyoi, Togula Britannica, T. jolla 종을 제외한 대부분의 종들이 본 연구에서도 확인되었다(김 등 2015).
해외의 경우, 2007년 5월부터 2010년 12월까지 러시아의 피오르트대제만 사질 조간대에서 수행된 연구에서는 총 25속 67종의 매우 다양한 저서와편모조류가 보고되었다(Selina 2016). 해당 연구에서는 3년이라는 긴 연구 기간과 조사 기간 중 기록된 넓은 수온 범위(-1.8–25.3°C) 및 염분 범위(2.1–35.5 psu)로 인해 다양한 종의 저서와편모조류가 관찰될 수 있었던 것으로 추정된다. 출현 속의 구성은 대부분 본 연구와 유사하였으나 국내 사질 조간대에서는 발견되지 않았던 Peridinium, Pileidinium, Sabulodinium 속의 출현이 확인되었다(Selina 2016). 이 연구에서 2009년 1월부터 5월 그리고 2월부터 4월까지 발생한 Thecadinium kofoidii와 Amphidiniopsis uroensis 종의 대번성으로 인해 Patroki Bay에서 저서와편모조류의 현존량이 최대 2,576 cells/cm3, Srednaya Bay에서 최대 595 cells/cm3로 매우 높게 관찰된 바 있다(Selina 2016). 하지만, 해당 시기를 제외하고는 저서와편모조류의 출현이 전혀 관찰되지 않았거나 본 연구보다 적은 개체수가 출현하였다. 제주도의 화산섬이라는 특성에도 불구하고, 500 미터에 달하는 넓은 조간대 환경, 높은 연평균 해수 온도, 용천수 및 염지하수의 유입 등 복합적인 환경 요인들이 표선 사질 조간대에 서식하는 저서생물들의 높은 종다양성에 기여하는 것으로 추정된다. 또한, 지속되는 지구 온난화와 제주 연안 환경의 급격한 변화에 따른 저서와편모조류 종의 출현 변화를 파악하기 위해서는 지속적이고 집중적인 모니터링 연구가 필요하다.
표선 조간대 사질 서식(sand-dwelling) 주요 출현 종
무각와편모조류인 Amphidnium속은 대표적인 사질 서식종(sand-dwelling species)으로 다양한 종들이 사질 조간대 환경에서 분포하는 알려져 있으며, 그 중 Amphidinium carterae, A. gibbosum, A. massartii, A. operculatum와 같은 종들은 amphidinols, Luteophanol 등과 같은 용혈성 독소를 생산하는 것으로 보고된 바 있다(Moreira- González et al. 2019). 본 조사 기간 중 확인된 Amphidinium속은 총 9종이었으며, 이 중 독소를 생산하는 것으로 알려진 A. carterae, A. gibbosum, A. massartii, A. operculatum의 출현이 확인되었다(Maranda and Shimizu 1996; Murray et al. 2012; Hoppenrath et al. 2014; Abreu et al. 2019). 국내 이전 연구에서는 2011년 표선에서 A. carterae, A. gibbosum이, 서해안 동호에서는 A. carterae와 A. operculatum이 출현했던 것으로 보고되었다(Shah et al. 2014; 김 등 2015). 이 중 A. carterae는 본 연구에서 5월과 7월에 출현했으나, 이전 표선 연구에서는 2월, 3월, 4월에, 동호 사질 조간대에서는 5월에 출현하여 해당 종의 출현 수온 범위는 12–27°C로 나타났다. A. gibbosum은 본 연구에서는 3, 4, 5, 7월에 출현했으나 이전 표선 연구에서는 11월에 출현하여 해당 종의 출현 수온은 13–22°C 범위를 보였다. A. operculatum의 경우, 본 연구 및 2011년 표선 조간대에서 6월에서 8월 하계에 출현했으나, 동호 사질 조간대에서는 늦가을부터 겨울철에 출현한 것으로 보고되었기에 해당 Amphidinium종들은 광온성 종(eurythermal species)으로 판단된다. 사질 조간대에서 발견된 A. mootonorum, A. operculatum, A. poecilochroum 종들은 18–31의 넓은 염분 범위에 걸쳐서 출현이 확인되어 광염성(euryhaline) 특징을 가지는 것으로 보고되었다(김 등 2015). 따라서 Amphidinium속의 많은 종들이 환경 적응 스트레스가 높은 조간대 저서 환경에서 높은 종다양성과 풍부도를 유지할 수 있는 적응 기작을 가지고 있을 것으로 판단된다. Amphidinium 외에도 잠재독성종으로 알려진 Prorocentrum concavum, P. rhathymum 종들이 발견되었는데 이들은 과거 표선 및 동호의 사질 조간대 연구에서는 보고되지 않았던 종들이다.
흥미로운 점은 조사 기간 동안 주로 부유성 종(planktonic species)으로 알려진 Heterocapsa속의 종들이 넓은 해수 온도 범위(13.7–26.9 °C)와 염분 범위(30.9–34.8)에서 다른 종들에 비해 비교적 높은 세포밀도로 관찰되었다는 것이다. 이들이 일시적으로 가라앉아 퇴적물에서 발견되었을 가능성을 배제할 수는 없지만, 관찰된 H. psammohila는 2011년 표선에서도 발견된 바 있으며, 동호 사질 조간대에서도 Heterocapsa sp.가 보고되었다(Shah et al. 2014; 김 등 2015). H. psammophila는 Heterocapsa 속 중 사질 서식성 종으로 최초 보고된 종이다(Tamura et al. 2005). 부유성 종으로 알려진 H. circularisquama과의 비교 배양실험에서 H. psammophila의 세포들이 바닥 및 모래 틈으로 이동하는 사질 서식성 행동 특성을 보이는 것으로 나타났다(Tamura et al. 2005). 사질 조간대에서 발견되는 Heterocapsa종들의 사질 서식성을 입증하기 위해서는 부유성 Heterocapsa종들과의 형태적, 계통학적, 생리학적 특성들에 대한 면밀한 비교 분석이 필요할 것으로 보인다.
5. 요약 및 결론
2022년 춘계부터 하계까지, 제주도 표선 사질 조간대에 서식하는 저서 미세조류의 현존량과 저서와편모조류의 출현 종 및 종다양성을 조사하였다. 조사 결과, 총 24속 48종의 저서와편모조류가 확인되었으며, 그 중 잠재 독성종 4종과 국내 미기록종 8종이 발견되었다. 해수온도 상승에 따른 저서 미세조류의 현존량 증가가 확인되었고, 계절 변화에 따른 저서와편모조류 출현 종의 변동도 관찰되었다. 특히, 담수유출수로 인한 퇴적물 함수율 증가와 영양염 공급은 깃돌말류(pennate diatom) 저서 미세조류의 개체수를 크게 증가시킬 수 있을 것으로 예상된다. 저서와편모조류는 환경 적응의 스트레스가 큰 조간대 상부보다는 조간대 중부 및 하부에서 높은 현존량을 보였으며, 종다양성도 대체로 조간대 하부로 갈수록 증가하는 경향이 나타났다. 본 연구를 통해 저서생태계의 주요 일차 생산자인 저서 미세조류들의 생태 및 종다양성 조사를 위한 체계적인 방법론을 확립하였으며, 그동안 연구가 부족했던 사질 조간대 저서 생태계에서 저서와편모조류의 종다양성과 생태적 역할을 파악하는 데 중요한 기여를 할 것으로 기대된다. 또한, 잠재 독성종의 존재로 인한 생태적 및 보건적 위험성이 확인되었으며, 이는 사질 조간대에서 저서와편모조류 종다양성 연구의 중요성을 강조하는 근거가 되었다. 향후 퇴적물 내 물리적, 화학적, 생물학적 요인을 종합적으로 고려한 지속적이고 집중적인 추가 모니터링 연구가 필요할 것이다.