1. 서 론
수해양 생태계에서 동물플랑크톤 중 가장 대표적인 분류군인 요각류(copepods)는 자·치어의 에너지 효율 및 초기 성장률, 초기 사망률을 결정하는 발생단계적인 먹이원(ontogenetic food sources)으로써 중요한 위치를 차지하고 있다(Sheldon et al. 1977; Van der Meeren and Næss 1993; Kiørboe 1997; Madhupratap 1999; Graeb et al. 2006). 또한 요각류는 물리적, 화학적 상태 변화에 민감하게 반응하기 때문에, 이들의 군집 구조를 파악하는 것은 해양 환경을 이해하는 데 큰 도움이 된다(Bonnet and Frid 2004). 특히, 전선역(frontal zone)은 물리-화학적으로 서로 다른 수괴가 만나 혼합이 이루어지며, 그 크기와 발생 기간이 매우 다양하기 때문에(Yang et al. 1991; Jeong et al. 2009; Son et al. 2010), 동물플랑크톤의 군집구조 변동에 매우 커다란 영향을 미칠 수 있다(Park and Choi 1997; Kim et al. 2019). 이 중 황해에 주로 나타나는 조석 전선(tidal front)(Lie 1989; Lü et al. 2010)은 현재까지 황해 중앙골 저층에서 형성된 냉수와 황해 연안수가 만나 형성되는 것으로 알려져 있다(Dunxin and Qingye 2004; Jang et al. 2011; Lie et al. 2013; Zhong et al. 2020). 그러나, 황해에서 수행된 동물플랑크톤 연구들 대부분은 연안으로부터 거리가 먼 외양(황해 중앙부를 포함하는)에서 수행되어 왔기 때문에(Lim et al. 2009; Sun et al. 2010; Kim and Kang 2019, 2020, 2021; Zhao et al. 2022), 많은 섬으로 이루어진 우리나라 황해 연안에서 일어나는 이들 현상과 연계성을 이해하는데 한계가 있다.
한편, 섬 주변 해역에서는 섬의 육상부에서 배출되는 물질과 지속적 또는 일시적으로 일어나는 용승작용 등에 의해 유입되는 영양염으로 인해 1차 생산력이 높은 지역으로 알려져 있다(Perissinotto et al. 2000; Bucciarelli et al. 2001; Messié et al. 2020). 그러나 이러한 현상의 확산과 직접적인 원인에 대한 생태학적 정보는 부족한 실정이다. 따라서 섬 주변 해역에서의 요각류 군집 구조 변동을 이해하고 이에 대한 물리화학적 현상과의 관련성을 파악하는 것은 중요한 연구 주제 중 하나이다. 본 연구해역인 황해 남부에 위치하는 영광 안마 군도는 안마도를 중심으로 석면도, 소석면도, 오도, 횡도, 죽도, 목섬 등의 작은 섬들로 이루어져 있다. 이 지역은 연중 바람의 강도가 세기 때문에 안마도 해상풍력단지, 낙월도 해상풍력단지와 같은 대규모 해상풍력단지 등의 개발이 예정되어 있다(Ju et al. 2022). 이러한 측면에서 볼 때, 강한 바람과 많은 섬들로 이루어진 본 연구해역의 특성을 고려하면 황해 외양에서 형성된 조석 전선 또는 황해저층냉수가 연안까지 충분히 영향을 줄 수 있을 것으로 판단되지만, 이를 생물해양학적인 관점에서 기술한 연구가 부족하다. 따라서 본 연구는 섬이 많은 황해 안마 군도를 중심으로 요각류 군집의 계절 변동과 변동에 미치는 요인을 파악하고, 황해 연안에서 발생한 물리적 현상을 생물해양학적 관점에서 기술하고자 하였다.
2. 재료 및 방법
환경요인 자료 수집
영광 주변 해역에서 요각류 군집의 계절 변동을 파악하기 위해 2020년 4월(봄), 7월(여름), 11월(가을), 2021년 1월(겨울)에 소형 해양조사선 에드오션호를 이용하여 안마도를 중심으로 21개의 정점에서 조사를 수행하였다(Fig. 1). 수온, 염분, 엽록소 a 농도, 탁도 및 용존 산소는 잠수형 형광광도계(ASTD 102, JFE Advantech, Japan)을 이용하여 측정하였다.
동물플랑크톤 채집
동물플랑크톤은 원추형 네트(망구 직경 45 cm, 망목 크기: 200 µm)를 이용하여 바닥 수심(bottom depth-1 m) 부터 표층(surface)까지 수직으로 채집하였다. 수심이 10 m 이하의 정점에서는 2–3회 채집하여 시료를 합하였다. 또한 정량분석을 위하여 네트 입구에 유량계(Model 488115, Hydro–Bios co., Germany)를 부착하여 여과해수량을 산출하였다. 채집된 동물플랑크톤은 현장에서 중성 포르말린으로 즉시 고정하여 최종 농도 5%가 되도록 하였다. 동물플랑크톤 종 동정과 출현 개체수 계수(counting)는 요각류의 출현 개체수가 최소 200개체가 넘도록 입구가 넓은 파이펫으로 5–20 mL를 분취한 후, 바닥이 5 mm 간격으로 분할된 UNESCO식 계수판에서 실시하였다. 요각류는 해부현미경(SMZ645, Nikon, Japan)을 이용하여 가능한 종 수준까지 동정하였다. 해부현미경으로 종 동정이 어려운 종은 종을 특정할 후 있는 부속지를 해부하여 영구표본을 만든 후, 보다 세밀한 관찰을 위해 고배율 광학 현미경(Eclipse E200, Nikon, Tokyo, Japan)을 사용하여 관찰하였다. 요각류 종 동정은 Chihara and Murano (1997), Soh (2010), Soh et al. (2013), Soh and Moon (2014)를 참고하였으며, 요각류 종명 및 분류 체계는 WoRMS Editorial Board (2023)에 준하여 정리하였다. 최종적으로 요각류 개체수는 inds. m-3으로 환산하여 분석에 사용하였다.
자료 분석
자료 분석에 사용된 요각류 개체수 데이터는 정규화와 데이터간 편차를 줄이기 위하여 log10(x+1) 지수로 변환하여 사용하였다. 환경 요인(수온, 염분, 엽록소 a 농도, 탁도, 용존 산소)에 대해서는 표층과 저층 자료의 평균값을 사용하였고, Z-score 표준화를 수행하여 단위를 제거하여 비교 가능하도록 하였다. 데이터 분석 전, 데이터의 편향(bias)을 야기할 수 있는 이상치(outliers)는 제거하였다. 각 요인은 변수별로 정규 분포를 만족하지 않기 때문에 계절에 따른 환경 요인의 통계적 차이는 비모수 분석인 Wilcoxon test와 Kruskal-Wallis test를 통해 확인하였다. 계절에 따른 군집 특성을 파악하기 위해 Bray-Curtis Dissimilarities를 기반으로 하는 Ward’s link method에 따라 계층적 클러스터 분석과 비계량적 다차원 척도(non-metric Multi-Dimensional Scaling, nMDS) 배열법 분석은 Jeong et al. (2022)에 따라 수행하였다. 이후, 계절별 군집 특성에 따른 계절군에 미치는 환경요인을 탐색하기 위해 정준상관분석(Canonical Correspondence Analysis, CCA) 과 상관분석(Correlation analysis)을 수행하였다. 모든 데이터 작업 및 통계 분석은 R program (version 4.1.0., R Core Team, 2020)의 두 가지 패키지(“ggplot2”, “vegan”)를 이용하였다.
3. 결 과
환경 요인
각 환경 요인(평균 수온, 평균 염분, 평균 엽록소 a 농도, 평균 탁도, 평균 용존 산소)은 안마도를 기준으로 동쪽과 서쪽으로 구분하여 계절별 변동 양상을 파악하였다(Fig. 2). 평균 수온(Averaged Temperature)은 봄에 9.7–13.6℃의 범위를, 여름에 19.7–22.8℃의 범위를, 가을에 18.0–18.5℃의 범위를, 겨울에 3.2–7.0℃의 범위를 보였다(Fig. 2). 평균 수온은 계절에 따른 차이가 뚜렷하게 나타났다(p < 0.001, Kruskal–Wallis test). 그리고 평균 수온은 수심이 얕고 연안에 가까운 안마도 동쪽 해역이 겨울을 제외한 모든 계절(봄, 여름, 가을)에서 높게 나타난 반면, 안마도 서쪽 해역은 계절에 따라 변동 양상이 달랐다(Fig. 2). 특히 여름에는 안마도 동쪽 해역에 비해 서쪽 해역에서 상대적으로 낮은 수온의 물(19.7℃)이 관찰되었는데, 이는 동쪽해역의 최고 수온(22.8℃)에 비해 약 3.1℃ 낮았다(Fig. 2).
평균 염분(Averaged Salinity)은 봄에 31.80–32.24 psu 범위를, 여름에 31.48–32.24 psu 범위를, 가을에 31.29–32.39 psu 범위를, 겨울에 31.26–32.14 psu 범위를 보였다(Fig. 2). 평균 염분은 봄–가을, 봄–겨울, 여름–가을, 여름–겨울 간에는 유의미한 차이를 보였지만(respectively p < 0.001, Wilcoxon test), 봄–여름, 가을–겨울 간에서는 유의미한 차이를 보이지 않았다(respectively p > 0.05, Wilcoxon test). 평균 염분은 안마도를 기준으로 모든 계절에서 수심이 얕고 연안에 가까운 동쪽이 낮게 나타난 반면 수심이 상대적으로 깊고, 연안으로부터 거리가 있는 서쪽 해역은 동쪽 해역에 비해 상대적으로 높게 나타나는 경향이었다(Fig. 2).
평균 엽록소 a 농도(Averaged Chlorophlly-a concentrations)는 봄에 1.67–7.73 μg/L의 범위를, 여름에 1.11–8.69 μg/L의 범위를, 가을에 1.67–8.62 μg/L의 범위를, 겨울에 0.61–3.62 μg/L의 범위를 보였다(Fig. 2). 평균 엽록소 a 농도는 봄과 가을(p > 0.05, Wilcoxon test)을 제외한 나머지 계절에서 모두 유의미한 차이를 보였으며(p < 0.05, Wilcoxon test), 계절에 따른 차이 또한 뚜렷하게 나타났다(p < 0.001, Kruskal-Wallis test). 또한, 안마도를 기준으로 모든 계절에서, 수심이 얕고 연안에 가까운 동쪽이 높은 평균 엽록소 a농도가 나타난 반면, 수심이 상대적으로 깊고 연안으로부터 거리가 있는 서쪽 해역은 동쪽 해역에 비해 상대적으로 낮게 나타났다. 다만, 가을에 동쪽 해역에 가까운 9번 정점에서 8.62 μg/L에 이르는 매우 높은 값이 관측되었다(Fig. 2).
평균 탁도(Averaged Turbidity)는 봄에 1.93–80.44 FTU의 범위를, 여름에 1.98–218.03 FTU의 범위를, 가을에 27.47–190.70 FTU의 범위를, 겨울에 2.61–81.70 FTU의 범위를 보였다(Fig. 2). 평균 탁도는 봄–가을, 여름–가을, 가을–겨울 간에 유의미한 차이(p < 0.001, Wilcoxon test)를 보인 반면, 나머지 계절 간에는 차이가 크지 않았다(p > 0.05, Wilcoxon test). 그럼에도 불구하고 계절에 따른 차이는 뚜렷하게 나타났다(p < 0.001, Kruskal-Wallis test). 여름에 연안과 가까운 3–6번 정점에서 높은 농도의 탁도 범위(178.47–218.03 FTU)가 관찰되었다(Fig. 2). 또한, 평균 탁도는 평균 엽록소 a 농도와 유사하게 모든 계절, 안마도 동쪽해역에서 상대적으로 높은 값을 보였다(Fig. 2).
평균 용존 산소(Averaged Dissolved Oxygen)는 봄에 8.28–9.80 mg/L의 범위를, 여름에 6.33–7.10 mg/L의 범위를, 가을에 5.53–7.04 mg/L의 범위를, 겨울에 9.47–10.45 mg/L의 범위를 보였다(Fig. 2). 여름–가을 간에 유의미한 차이가 없었던 반면(p > 0.05, Wilcoxon test), 나머지 계절 간에서 유의미한 차이가 나타났다(p < 0.001, Wilcoxon test), 평균 용존 산소 또한 계절적인 차이가 뚜렷하게 나타났다(p < 0.001, Kruskal-Wallis test). 봄과 여름에는 안마도 동쪽 해역에서 상대적인 낮은 값의 분포를 보인 반면, 안마도 서쪽 해역에서는 높은 값의 분포를 보였다(Fig. 2). 그러나 가을과 겨울에는 이와 반대로, 안마도 동쪽 해역(또는 안마도 동쪽 해역과 가까운 정점)이 상대적으로 매우 높은 값의 분포를, 안마도 서쪽 해역이 상대적으로 낮은 값의 분포를 보였다(Fig. 2).
계절별 요각류 종구성과 군집에 미치는 환경 요인
조사 기간 중 요각류는 봄에 8–6,191 inds. m-3, 여름에 8–8,601 inds. m-3, 가을에 9–7,424 inds. m-3, 겨울에 6–3,523 inds. m-3의 범위로 정점에 따른 큰 폭의 출현 개체수 변동을 보였다(Fig. 3a). 전 계절 Acartia hongi, Paracalanus parvus s. l., Ditrichocorycaeus affinis가 우점적으로 출현하였으며, Acartia ohtsukai, A. pacifica, Bestiolina coreana, Centropages abdominalis, Labidocera rotunda, Paracalanus sp., Tortanus derjugini, T. forcipatus는 계절과 정점 별로 출현 개체수가 달랐다(Fig. 3, Table 1).
Table 1.
Seasonal occurrence list of copepods in the Anma Islands of Yeonggwang
계절에 따른 요각류 군집 특성을 파악하기 위해 수행한 Bray–Curtis 비유사도 기반의 nMDS 결과는 3개의 계절군(A: 봄, 겨울, B: 여름, C: 가을)으로 구분되었다(Fig. 4a and b). CCA 분석 결과를 살펴보면, 제1, 2축의 전체 자료 분산에 대한 누적 기여율은 76.50%와 15.05%를 나타냈고, 5개의 환경요인이 계절별 요각류 변동의 91.55%를 설명하였다(Fig. 5). Group A (봄, 겨울)와 일부 Group B (안마도 서쪽 해역)는 주로 평균 용존 산소가 A. hongi, C. sinicus, C. abdominalis 와 양의 상관관계를 나타내었다. Group A와 겹치지 않는 안마도 동쪽 해역을 포함하는 Group B (여름)는 주로 평균 온도 및 평균 Chl-a 농도가 A. ohtsukai와 C. teuiremis 와 양의 상관관계를 나타내었다(p < 0.05, Table 2). Group C (가을)는 평균 Chl–a 농도, 평균 탁도가 A. pacifica, C. dorsispinatus, Paracalanus sp.와 양의 상관관계를 나타내었다(p < 0.05, Table 2). 전 계절에 모두 출현하고, 주로 우점하는 P. parvus s. l.은 평균 염분과 약한 음의 상관관계(correlation coefficient: -0.2499)를, D. affinis는 평균 염분과 약한 양의 상관관계(correlation coefficient: 0.1284)가 나타났다(Table 2), 또한, 연구해역에서 연중으로 출현하는 A. hongi와 P. parvus s. l.을 제외한 나머지 종들은 먹이에 대해 크게 반응함을 확인하였다(p < 0.05, Table 2).
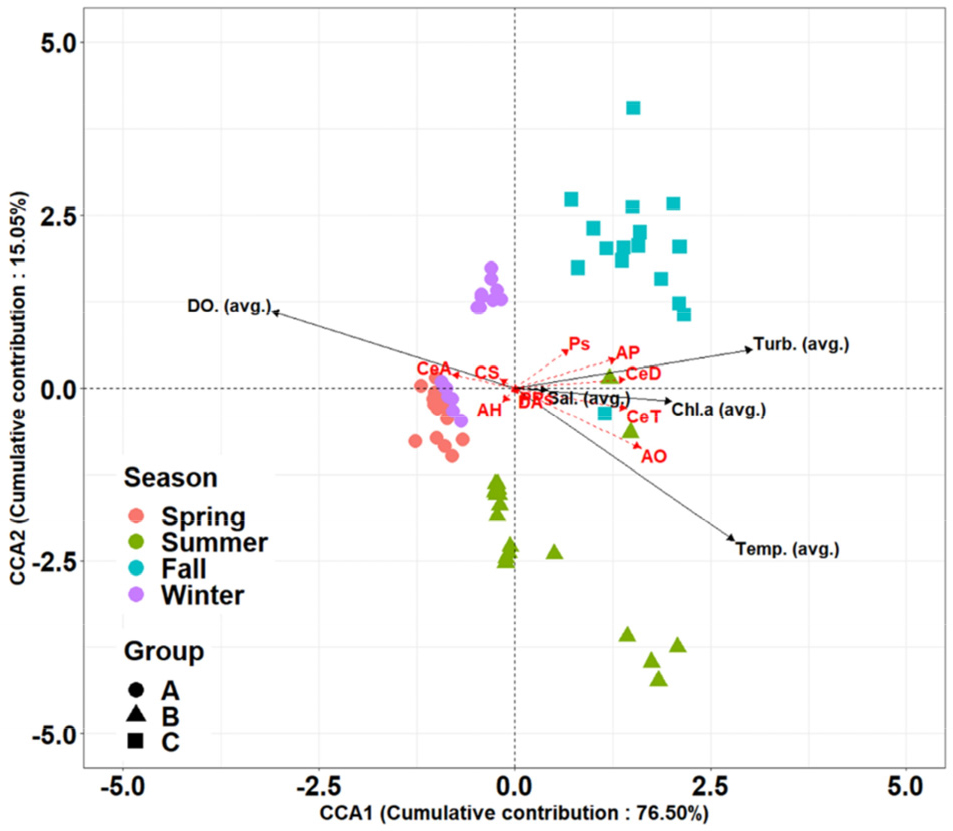
Fig. 5.
Ordination plot of the canonical correspondence analysis (CCA) showing the major copepods and seasonal occurred copepods in relation to the physicochemical and biological factors. Abbreviations: AH: Acartia hongi, AO: A. ohtsukai, AP: A. pacifica, CS: Calanus sinicus, CeA: Centropages abdominalis, CeD: C. dorsispinatus, CeT: C. tenuiremis, PPs: Paracalanus parvus s. l., Ps: Paracalanus sp., DA: Ditrichocorycaeus affinis
Table 2.
Results of Spearman's correlation analysis between dominant or seasonal copepods and environmental factors. Asterisks indicate that correlation is statistically significant (*p < 0.05, **p < 0.01, ***p < 0.001)
4. 고 찰
황해 남부 영광 연안에 출현하는 요각류의 계절적인 군집구조 양상을 파악한 결과, 사계절 모두 내만종에 의해 군집이 유지되는 것으로 확인되었다. 연구 해역에서 전 계절 모두 출현한 종은 Acartia hongi, Calanus sinicus, Ditrichocorycaeus affinis, Labidocera euchaeta, Paracalanus parvus s. l., Oithona spp. 였고, 계절적으로 출현한 종은 Acartia ohtsukai, A. pacifica, Bestiolina coreana, Centropages abdominalis, L. rotunda, Paracalanus sp., Tortanus derjugini, T. forcipatus이었다(Table 1). 이들 중 눈에 띄게 변동이 관찰되는 종은 A. hongi와 P. parvus s. l.이었다(Fig. 3b). A. hongi의 양적인 변동은 봄에 98–5,548 inds. m-3로 가장 많은 비율(37.2%)을 차지하였고, 가을로 가면서 9–90 inds. m-3로 큰 폭으로 감소하였다가 겨울에 256–2,984 inds. m-3로 증가하였다. A. hongi는 황해 고유종으로 황해에서 전반적으로 출현하고(Soh and Suh 2000), 겨울과 봄에 우점하여 출현한다고 보고되어 있다(Seo et al. 2018). 본 연구 기간 내에서도 겨울과 봄에 많이 출현한 것을 확인할 수 있었다. P. parvus s. l.의 양적인 변동은 봄에 82–1,578 inds. m-3로 출현 요각류 중에서 적은 비율(10.4%)을 차지하고 있었으나, 가을에 1,516–7,424 inds. m-3로 큰 폭으로 증가하여 가을에 출현한 요각류 중 가장 많은 비율(70.2%)을 차지하였다. P. parvus s. l.은 우리나라 연안에서 연중 출현하며, 여름에 개체군의 생식활동이 활발한 종으로 인식되어 왔다(Soh and Suh 1993; Lee et al. 2006; Moon et al. 2010). 가을에 이 종이 극우점하는 경향은 여름에 개체군의 생식활동이 활발했기 때문으로 판단된다. 한편 가을에 소수 출현하는 Paracalanus sp.는 P. parvus s. l.과 크기에서 명확한 차이를 보이고 있으나, 형태적으로는 매우 유사한 점을 많이 공유하고 있었다. 최근에 후자는 Ueda et al. (2022)이 동북아시아에 출현하는 종을 한정해 P. orientalis로 새롭게 명명하였으나, 여전히 국내에 출현하는 종은 크기 이외에도 개체 별 변이를 다수 포함하고 있어 추후 이와 관련한 분류학적 및 유전학적 검토가 이루어져야 할 것으로 보인다. 여름에만 출현하는 A. ohtsukai는 안마도 동쪽 해역, 수심이 얕은 지역(1–6번 정점)에만 한정하여 14–83 inds. m-3만 출현하였고, 가을에만 출현한 A. pacifica는 안마도 서쪽해역을 중심으로 10–66 inds. m-3 출현하였다. 다만, 가을의 경우에는 안마도 동쪽해역(1–5번 정점)에서 조사를 수행하지 못했기 때문에 동쪽과 서쪽을 비교할 수 없었다. 그리고 A. ohtsukai와 A. pacifica는 형태적으로 유사해 보이지만, 전자는 < 32 psu에서 우점한 반면, 후자는 > 32 psu 염분 범위를 선호하는 것으로 알려져 있다(Youn and Choi 2003; Moon et al. 2008; Soh 2010). 그리고 봄과 겨울에만 출현한 C. abdominalis는 봄에 16–83 inds. m-3, 겨울에 29–510 inds. m-3 출현하였지만, 전체 요각류 대비 출현 비율은 적은 편(각 8.2%, 6.2%)에 속했다. 이 종은 온도가 낮은 계절 또는 낮은 물에서 주로 출현하는 냉수종의 특성이 반영된 것으로 판단된다(Uye et al. 1979; Slater and Hopcroft 2005).
요각류를 대상으로 집괴 분석을 실시한 결과, 연구해역은 봄과 겨울 그룹(Group A), 여름 그룹(Group B), 가을 그룹(Group C)으로 구분되었다(Figs. 4 and 5). 그러나 Group B 중 상대적으로 수심이 깊은 정점들이 nMDS와 CCA ordination plot 상에서 Group A와 겹쳐서 나타났다(Figs. 4b and 5). 이들 정점에서는 여름임에도 불구하고 C. sinicus가 평균 용존 산소와 양의 상관성을 보이면서 다량 출현하였다(Figs. 5 and 6). 또한, Group A 와 겹치지 않는 Group B의 경우는 서로 영향을 주는 환경 요인이 다르게 나타났다. 이는 같은 계절 내에서도 환경에 따라 서식하는 요각류 종의 출현 양상이 다를 수 있음을 의미한다. Group A와 일부 겹치는 Group B는 평균 용존 산소와 C. sinicus 간에 양의 상관성을 나타내었고, 상대적으로 깊은 수심을 가진 정점이 포함되었다. Group A와 겹치지 않는 Group B에서는 평균 수온, 평균 염분 및 평균 Chl–a 농도와 계절적으로 출현하는 종(A. ohtsukai, C. tenuiremis) 간에 양의 상관성을 나타내었고(p < 0.05, Table 2), 평균 염분과는 약한 음의 상관관계를 나타내었다. 전자는 저층에 존재하는 상대적으로 저수온인 물이 영향을 미친 것으로 생각할 수 있다. 저수온의 물이 저층에서 표층으로 상승하면서 Chl–a 농도가 높아질 것으로 예측했지만, 본 연구의 결과에서는 저수온 물이 관찰된 표층 지역에서 Chl–a 농도가 연안보다 낮은 값을 나타내었다(Fig. 6). 이러한 현상은 이전 연구에서 관찰된 현상과 일치하였다(Lee et al. 2012; Kim and Kang 2021). 따라서, 저수온 물의 영향을 받은 지역에서는 먹이가 부족한 환경으로 볼 수 있지만, 후자의 경우에는 수심이 얕고 먹이가 풍부한 여름 연안 환경으로 판단할 수 있었다. 그리고 Group C는 다른 그룹들과 완전히 다른 특성을 나타내며, 주로 평균 Chl-a 농도, 평균 탁도와 양의 상관성을 보였다. 이 그룹에 반응하는 종들(A. pacifica, C. dorsispinatus, Paracalanus sp.)은 가을에 주로 출현하는 것으로, 가을의 환경이 먹이가 많고 탁도가 높은 환경과 주로 양의 상관성을 보이는 것은 육상으로부터 영얌염이 유입되어 동물플랑크톤의 먹이(식물플랑크톤)의 양과 다양성이 증가했기 때문으로 추정된다(Ju et al. 2022). 이처럼 계절 간에서 공간적인 요각류의 출현 양상이 다른 이유는 기존의 많은 연구 결과처럼 수온과 먹이 환경이 조절 인자(controlling factor)로 작용한 것으로 보인다(Fielder 1992; Martino and Houde 2010; Kang et al. 2013).
본 연구에서 흥미로운 사실은 여름에 안마도 주변해역에서 나타나는 저온 수괴와 냉수성 요각류인 C. sinicus의 다량 출현이다(Fig. 6). 냉수성 요각류인 C. sinicus는 황해지역에서 주로 온도가 낮은 바닥에 개체군이 집중되어 있는 경향이 있을 뿐만 아니라, 온도가 높아진 여름에 황해저층냉수에서 하면을 하는 것으로 알려져 있다(Wang et al. 2003). 한편, 연구지역을 포함하는 황해는 조차가 매우 심하고 조석 전선이 형성되는데, 이러한 현상들은 동물플랑크톤의 변동에 크게 영향을 줄 수 있다. 황해 동물플랑크톤에 영향을 미칠 수 있는 물리적인 기작(mechanism) 중 하나는 계절적 변동이 두드러지게 나타나는 황해저층냉수(Yellow Sea Bottom Cold Water, YSBCW)의 거동이다(Yang et al. 2014; Sun et al. 2022). 황해저층냉수의 남하 정도는 매년 다르지만, 제주 서부~동중국해까지 영향을 미치는 것으로 알려져 있다(Zhang et al. 2008; Moon et al. 2009; Yang et al. 2014; Kang and Moon 2022). 현재까지 황해 중앙골 저층에서 형성된 냉수와 황해 연안수가 만나 형성된 조석 전선에 대한 물리학적 관찰은 흑산도, 진도, 홍도 해역에서 저수온 현상의 확장이 많이 관찰되었고(Dunxin and Qingye 2004; Jang et al. 2011; Lie et al. 2013; Zhong et al. 2020), 이러한 현상은 쓰시마 난류와 같은 외해수의 유입으로 인한 연안 용승으로 인해 일어날 수 있다고 보고하였다(Jeong et al. 2009; Lee et al. 2012). 그러나 안마도 주변 정점에서 여름에 나타나는 저수온 수괴(Figs. 2 and 6)는 이들 연구 지역과는 멀리 떨어진 황해 중동부에 더 가깝기 때문에 외해수의 유입으로 인한 연안 용승일 가능성은 낮을 것으로 판단된다. 황해 지역에 형성되는 조석 전선 또한 이 개체군의 거동에 영향을 미칠 수 있다. 황해의 조석 전선은 상대적으로 수온이 높은 황해 연안수와 찬 성질의 황해 중앙해역의 수괴가 만나는 지점에서 형성되어 황해 해양생태계에 큰 영향을 미칠 수 있다. 특히, 조석 전선에서 형성되는 수괴는 영양염과 용존 산소 등의 환경 조건의 영향을 받아 생물의 군집 구조와 생산성을 크게 바꾸는 역할을 한다(Kim et al. 2000). 본 연구에서는 조석 전선의 형성 범위를 특정하기 어려웠지만 2020년 여름(7월)에 안마도 남서쪽 해역에서 주변 온도보다 온도가 낮은 수괴가 관찰되었다(Figs. 2 and 6). 이러한 현상이 조석 전선에 의해 발생한 것인지 확인하기 위해 한국해양자료센터(Korea Oceanographic Data Center, KODC)의 정선관측자료를 참고하였다. KODC 자료에 의하면(Fig. 7) 2020년 6월의 낮은 표층 수온(SST)이 황해 북부 해역에 크게 영향을 미치고 있었고, 8월에 표층 수온은 황해 북부 해역부터 황해 동부에 이르기까지 전반적으로 낮았다. 그러나 연안으로부터 유출되는 연안수는 상대적으로 온도가 높게 나타났다. 이러한 결과로부터 조사 기간 동안 영광 인근 해역 근처에서 조석 전선이 형성되고 있음을 간접적으로 추정할 수 있었다. 이외에 섬 질량 효과(Island Mass Effect, IME)에 의한 국지적인 연안 용승의 효과를 들 수 있다. IME에 의해 국지적인 연안 용승 현상이 발생한 곳은 전 세계적으로 대부분 섬이 많고, 바람이 많이 작용하는 곳으로, 본 연구 해역과 비슷한 양상을 보이는 것으로 파악되었다(Table 3). 또한 Baek and Kim (2018)은 남풍 계열의 바람이 3–4일 이상 지속적으로 강하게 우점할 때, 해저지형의 영향으로 한반도 남동해역에서 연안 용승이 주로 발생한다고 보고하였고, 이를 판단할 수 있는 근거로써, 낮은 수온, 높은 염분 농도, 높은 영양염류(질소화합물(NOx), 인산염 등), 높은 Chl–a 농도 등을 제시하였다(Takahashi and Kishi 1984; Baek and Kim 2018). 그럼에도 불구하고, 여름에 안마도 주변 해역에서 나타난 상대적으로 낮은 수온의 수괴(표층: 19.7–22.8℃, 저층: 17.9–22.7℃)는 황해저층냉수의 수온(< 12℃)(Choi 2011)에 비해 매우 높았고, 주변수와 최대 3–5℃ 정도 밖에 차이가 나지 않기 때문에 냉수종인 C. sinicus가 다량 출현했음에도 황해저층냉수의 영향을 단정할 수 없었다.
Table 3.
A regional list of topographical conditions and wind-induced coastal upwelling phenomena associated with Island Mass Effect (IME)
| Countries | Regions | Observation range | Periods | Observed Phenomena | References |
| China |
Bohai and Yellow seas |
Nearshore to Offshore (the Oceanographic Research Vessel Sharing Plan of the National Natural Science Foundation of China) |
Summer, 2019 |
A relatively colder and saltier water core exists from the bottom to the surface along the northeastern flank of Subei Bank | Wang et al. (2021) |
| China |
Zhejiang and Fujian Coast |
Zhoushan Islands in north of Zhejiang, Dongtou Archipelago in south of Zhejiang, Mazu Archipelago in the middle of Fujian |
January, February, July, October, 2000–2004 |
Wind-Gradual bathymetric slope-driven coastal upwelling | Jing et al. (2007) |
| India |
Southeastern Arabian Sea |
Southeastern Arabian Sea (SEAS) region | 1998–2016 |
High Chlorophyll a concentration | Shafeeque et al. (2021) |
| Japan |
around the Izu lslands | around the Izu lslands |
16, 17, and 20 September 1980 |
High nutrient supply and productivity | Takahashi and Kishi (1984) |
|
Korea, Republic of |
Eastern part of Yellow Sea |
Nearshore to Offshore (NIFS Serial Oceanographic observation) |
June 26– July 3, 2009 |
Relatively low temperature, high dissolved oxygen concentration, and low turbidity in the surface layer | Lee et al. (2012) |
한편 Kang et al. (2013)은 성층화가 뚜렷한 여름, 황해에서 수온이 높은 표층 환경을 피하기 위해 낮은 수온이 존재하는 저층에서 C. sinicus가 약한 DVM (diel vertical migration) 패턴을 보인다고 보고하였다. 이는 C. sinicus가 여름에 하면을 하는 것이 아닌 약하지만 주·야간의 수직 이동을 하고 있음을 의미한다. 따라서 여름 안마도 서쪽 해역에서 나타나는 C. sinicus의 출현은 물리적인 기작에 의한 이동이 아니라 이 종이 자발적으로 저수온을 따라 이동할 수 있음을 의미할 수 있다. 그럼에도 불구하고 황해에서 수산생물의 먹이로서 C. sinicus의 중요성을 고려할 때, 향후 여름 안마도 서쪽 해역에서 나타나는 저수온의 출현 및 거동이 C. sinicus 개체군 유지 전략에 어떻게 작용하고 있는 지에 대한 연구는 필요해 보인다.
5. 결 론
본 연구 결과에 따르면, 황해 안마 군도 해역에서 관측된 요각류 군집은 계절에 따라 우점종과 계절적으로 출현하는 종으로 구분할 수 있었으며, 각 그룹별로 다른 환경 요인과의 상관성을 나타내었다. 하지만, 이러한 요각류 군집의 분포와 출현 패턴은 단순히 환경 요인에 의해 설명되지 않으며, 복잡한 요소들의 작용으로 인해 영향을 받을 수 있다. 특히, 영광 안마 군도 생태계에서의 섬 질량 효과는 여러 가능성(저수온의 확장, 해류와 경사 지형에 의한 국지적인 연안 용승 현상, 풍성 순환)을 모두 포함할 수 있으며, 이러한 요소들이 복합적으로 작용하여 수온, 염분, 생물의 분포 변화를 유발할 수 있다는 것을 알 수 있다. 하지만, 본 연구에서는 사용한 데이터 세트의 시간적, 공간적인 범위가 제한적이며 다양한 환경 요인의 상호작용에 대한 분석과 복합적인 요인에 의한 여러 가능성을 뒷받침할 수 있는 명확한 근거는 부족하였다. 따라서, 이 해역에서 일어나는 복잡한 현상을 정의하고, 정량화 하기 위해서는 보다 상세한 후속 연구가 필요할 것으로 판단된다.










