1. 서 론
2. 재료 및 방법
환경 요인 측정
동물플랑크톤 채집 및 시료 처리
동물플랑크톤 개체수 및 생체량 분석
통계 분석
3. 결 과
환경 요인
수층별 동물플랑크톤의 현존량과 탄소량
동물플랑크톤 분류군별 수직 분포
요각류의 수직 분포
4. 토 의
동물플랑크톤 주야 수직 분포 양상
환경 요인과 동물플랑크톤 수직 분포의 관계
5. 결 론
1. 서 론
대양 생태계에서 동물플랑크톤은 에너지 전달과 물질 순환의 핵심적인 역할을 수행한다(Steinberg and Landry 2017; Tao et al. 2022). 이들은 해양 먹이망에서 일차 생산자인 식물플랑크톤이 생산한 유기물을 상위 영양 단계로 전달하는 중요한 매개체 역할을 하며(Burd et al. 2010; Franco-Cisterna et al. 2021; Shea et al. 2023), 생물학적 펌프(biological pump)의 주요 구성 요소로서 탄소와 영양염의 수직 수송을 촉진하여 해양의 생지화학적 순환에 중요한 기여를 한다(Stukel et al. 2013; Steinberg and Landry 2017; Tao et al. 2022).
동물플랑크톤은 표층에서 심해까지 다양한 수층에 분포하며(Vinogradov 1997; Bode et al. 2015), 이들의 수직 분포는 시간에 따라 변화하고, 특히 일부 종들은 주야간 수직 분포에 큰 차이를 나타낸다(Hays 2003). 이러한 주야간 변동은 해양 내 수층간 에너지 및 물질에 중대한 영향을 미친다(Bianchi et al. 2013; Archibald et al. 2019; Hernández-León et al. 2019). 따라서 동물플랑크톤의 주야간 수직 분포를 비교하는 것은 이들의 생태적 역할을 이해하는 데 필수적이다. 더불어, 표해수대(epipelagic zone, 0–200 m)부터 중층표영대(mesopelagic zone, 200–1,000 m), 그리고 점심해대(bathypelagic zone, 1,000–4,000 m)에 이르는 전 수층에 걸친 동물플랑크톤 분포를 파악함으로써 해양 생태계의 수직적 구조와 기능을 포괄적으로 이해할 수 있다.
최근 해양 생태계 연구에서는 중층표영대의 동물플랑크톤에 대한 관심이 증가하고 있다(Proud et al. 2017; Sutton et al. 2017). 이는 중층표영대 동물플랑크톤이 생물학적 펌프의 핵심 구성 요소로 작용하며, 해양 생태계 및 전 지구적 물질 순환에서 중요한 역할을 한다는 인식이 확산되었기 때문이다. 예를 들어, Kiko et al. (2020)은 중층표영대 동물플랑크톤이 연간 탄소 수송에 중요한 역할을 하며, 특정 지역에서는 침강하는 유기 탄소의 최대 50%를 중층으로 전달한다고 보고했다. 나아가 기후 변화가 중층표영대의 동물플랑크톤 군집 구조, 생물량 분포 및 생태적 기능에 미치는 영향을 이해하는 것이 점점 더 중요해짐에 따라 이 분야의 연구는 더욱 활발히 진행되고 있다. 예를 들어, Hernández-León et al. (2020)은 중층표영대 동물플랑크톤이 전체 수층 동물플랑크톤 생물량의 약 47%를 차지하며, 표해수대에 비해 1.5–26배 더 많은 양을 보인다고 보고했다. 또한, Kelly et al. (2019)은 중형동물플랑크톤의 일주 수직 이동을 통해 중층표영대로 운반되는 활성 탄소 플럭스가 전체 탄소 수송량의 18–84%(평균 약 42%)를 차지할 수 있다고 추정했다. 이러한 연구 결과는 중층표영대 동물플랑크톤의 중요성을 뒷받침하며, 다양한 해역에서 관련 연구의 필요성을 강조한다. 그러나 연안 해역에 비해 대양에서의 중층표영대 동물플랑크톤 연구는 상대적으로 부족한 실정이다. 이는 대양의 광대한 면적, 접근성 문제, 그리고 기술적·경제적 제약 등 여러 요인에 기인하지만, 전 지구적 해양 생태계와 기후 시스템에서 대양이 차지하는 중요성을 고려할 때, 대양에서의 이러한 연구가 시급히 요구된다(Robinson et al. 2010).
북동태평양 적도 인근 해역에서의 동물플랑크톤 연구는 대부분 표해수대에 초점을 맞추고 있으며(Le Borgne et al. 2003; Fernández-Álamo and Färber-Lorda 2006), 특히 본 연구 해역인 클라리온-클리퍼톤 균열대(Clarion- Clipperton Fracture Zone, CCFZ)에서는 심해 저서 생태계와 망간단괴 채광의 잠재적 영향에 관한 연구가 주를 이루고 있다. Kang et al. (2007)은 이 해역에서 동물플랑크톤 수층별 군집 조성을 조사했으나, 주로 표해수대에 초점을 맞추고 있어 중층표영대 이하의 정보는 매우 부족하다. Christiansen et al. (2020)과 Drazen et al. (2020)은 CCFZ를 포함한 심해 채광 해역의 중층 생태계 중요성을 언급했지만, 이 수층의 동물플랑크톤 군집 구조, 수직 분포, 생물량 및 생태학적 역할에 대한 직접적이고 상세한 연구는 아직 이루어지지 않았다.
이러한 배경을 바탕으로, 본 연구는 CCFZ 해역에서 표해수대부터 중층표영대에 이르는 동물플랑크톤의 주야간 수직 분포 특성을 조사하였다. 이를 통해 CCFZ 해역 동물플랑크톤 군집 구조와 그 변화 양상을 심층적으로 이해하고자 하였다. 특히, 본 연구는 중층표영대 동물플랑크톤에 대한 기존의 부족한 연구를 보완하며, 동물플랑크톤의 수직 분포와 이에 영향을 미치는 환경 요인에 대한 새로운 정보를 제공하고자 한다. 이러한 결과는 CCFZ의 표영대와 중층표영대 생태계에서 동물플랑크톤의 역할을 이해하는 데 기여하며, 나아가 기후 변화와 심해 채광 활동이 이 해역의 해양 환경에 미칠 잠재적 영향을 평가하는 데 중요한 과학적 기반으로 활용될 것이다.
2. 재료 및 방법
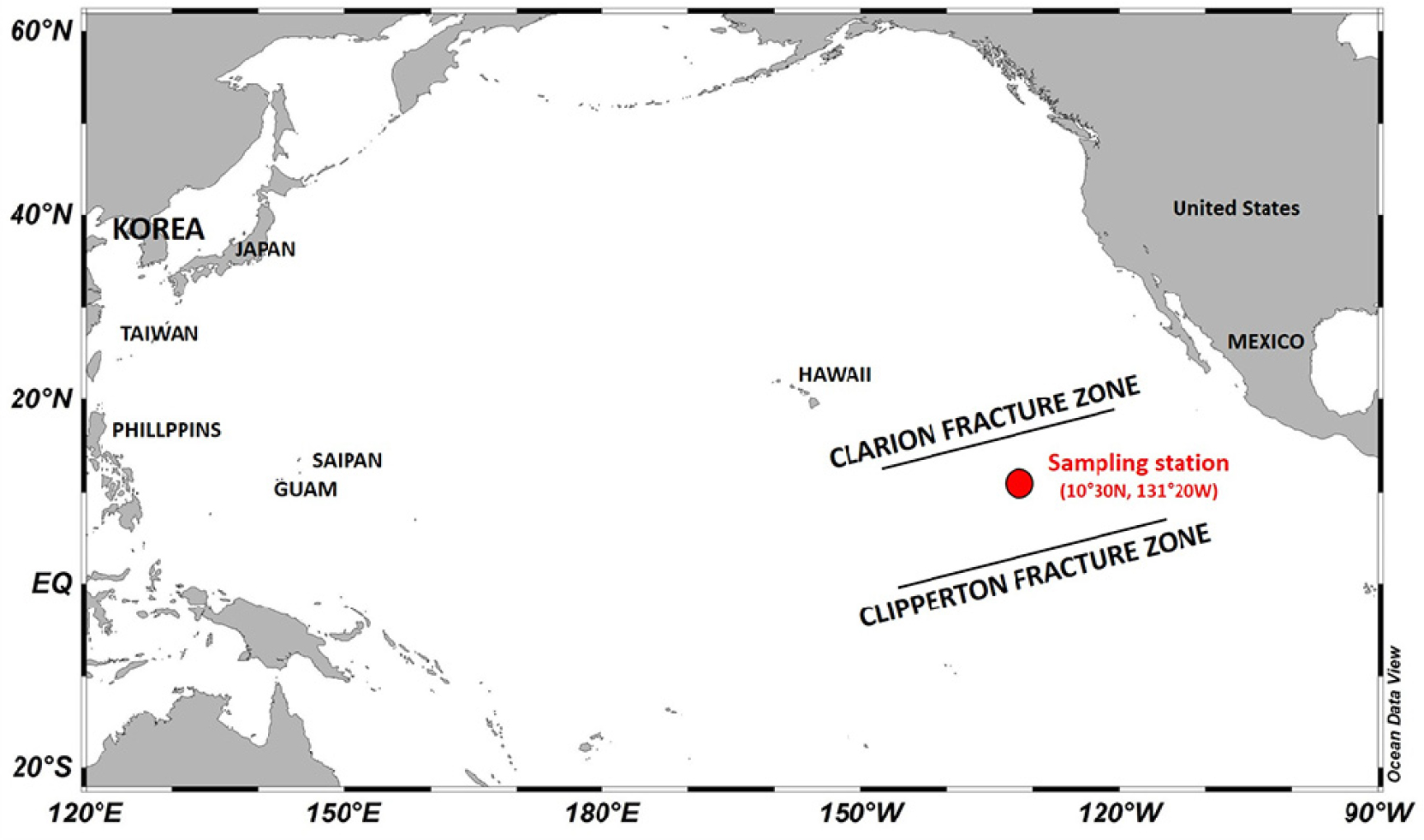
본 연구는 2019년 3월 23일부터 24일까지, 북동태평양 클라리온-클리퍼톤 균열대에 위치한 정점(위치: 10° 30'N, 131°20'W)에서 수행되었다(Fig. 1). 현장 조사는 미국 하와이대학교의 연구선 Kilo Moana를 이용하여 주야간에 걸쳐 표해수대부터 중층표영대까지의 동물플랑크톤을 채집과 환경 요인을 측정하였다.
환경 요인 측정
수온과 염분은 CTD (SBE 911+, Sea-Bird Electronics Inc.)를 사용하여 측정하였고, 식물플랑크톤의 엽록소 농도는 CTD에 부착된 형광센서(Seapoint Sensors Inc.)를 통해 파악하였다. 용존산소는 CTD에 부착된 센서(SBE 43, Sea-Bird Electronics Inc.)로 측정되었으며, Winkler Sodium Azide 방법을 통해 채수한 시료의 농도를 분석하여 보정하였다(Reddy and Parameshwar 2016; Van Ganse et al. 2019).
무기영양염 분석을 위한 시료는 염산과 3차 증류수로 세척된 60 mL HDPE 용기를 사용하여 현장에서 채취한 후 냉동(-20°C) 상태로 보관하였다. 이후 실험실로 옮겨 영양염 자동분석기(Quaatro, Seal Analytical)를 이용하여 분석을 진행하였다. 분석된 항목은 암모늄(Ammonium), 질산염(Nitrate), 인산염(Phosphate)과 규산염(Silicate)이다. 각 항목별 회수율은 MOOS3(NRCC) 표준용액을 사용하여 검증하였으며, 질산염 99%, 인산염 96%, 규산염 102%로 확인되었다.
입자성 유기질소(Particulate Organic Nitrogen, PON) 및 입자성 유기탄소(Particulate Organic Carbon, POC) 분석은 현장에서 채취한 해수 시료 500 mL를 저진공 압력식 여과 장치를 이용하여 450°C에서 4시간 이상 태운 GF/F 유리섬유 필터(직경 25 mm, Whatman)로 여과한 후 냉동 보관하였다. 이후 실험실로 옮겨 무기탄소 제거를 위해 염산(10 N) 훈증(acid fuming)을 실시하고 건조한 뒤, 주석 용기(tin capsule)에 담아 CHNS 분석기(Model FLASH EA1112, Thermo)를 이용해 분석하였다. 표준물질로는 Cystine (탄소 29.99%, 질소 11.66%, Thermo)을 사용하였으며, 공시료에 대한 농도 보정은 고온에서 태운 여과지를 동일한 방법으로 처리하여 분석한 값을 이용하였다.
동물플랑크톤 채집 및 시료 처리
동물플랑크톤은 Multiple Opening/Closing Net and Environmental Sensing System (MOCNESS; 망구 면적 1.0 m2, 망목 크기 200 μm)를 이용하여 총 7개의 수층(0–50, 50–100, 100–200, 200–300, 300–500, 500–700, 700–1,000 m)에서 경사 예인(oblique tow) 방식으로 채집되었다. 주야간 분포 변화를 조사하기 위해 주간(09:00–18:00, 현지 시간)과 야간(19:00–03:00, 현지 시간)에 채집을 수행하였으며, 여과 해수량은 네트 입구에 부착된 유량계를 사용해 측정하였다. 채집된 시료는 군집 분석 및 생체량 측정을 위해 동일한 양으로 분할하였으며, 최종 농도가 5–10%가 되도록 중성 포르말린으로 고정한 후 실험실로 운반하였다.
동물플랑크톤 개체수 및 생체량 분석
동물플랑크톤 군집 분석을 위해 실험실에서 시료를 균일하게 혼합하고 부표본을 추출하였다. 부표본은 Bogorov 계수판을 이용하여 해부현미경(Leica M125)으로 형태적 동정과 계수를 진행하였다. 요각류는 속(genus) 수준까지 동정하였으며, 그 외 분류군은 강(class) 이상의 수준으로 구분하였다. 분류된 동물플랑크톤의 개체수는 단위체적당 개체수(개체수/m3)로 환산하였다.
생체량 측정을 위한 동물플랑크톤 시료는 스테인리스 체망을 사용하여 5개 크기 그룹(0.2–0.5 mm, 0.5–1 mm, 1–2 mm, 2–5 mm 및 5 mm 이상)으로 분류하였다. 분리된 시료는 Whatman GF/D 여과지(직경 47 mm)를 사용하여 습식 여과한 후, 증류수로 세척하여 포르말린과 염분을 제거하였다. 그 후, 시료는 건조기(60°C)에서 48시간 동안 완전히 건조시킨 후 데시케이터에서 30분간 방랭하였다. 건조된 시료는 전자저울(정밀도: 0.0001 g)로 무게를 측정하였으며, 연속 3회 측정에서 무게 변화가 0.0001 g 이하일 때 항량에 도달한 것으로 간주하였다. 포르말린 고정으로 인한 유기물 손실(25%)에 대한 보정(McLaren et al. 1989)과 건중량의 45%가 탄소량이라는 가정(Ara 2001; Peterson et al. 2002; Lee et al. 2011)을 바탕으로 동물플랑크톤의 탄소량을 계산하였다.
통계 분석
본 연구에서 얻어진 데이터는 SPSS (IBM SPSS Statistics 27, Professional KoreaPlus module)를 사용해 기본 통계 처리를 하였고, 동물플랑크톤의 수직 분포 차이를 분석하기 위해 일원분산분석(ANOVA)을 수행하였다. 주야간 수직 분포 차이를 비교하기 위해 대응표본 t검정(paired t-test)을 적용하였다. 또한, 동물플랑크톤의 수직 분포 특성을 정량화하기 위해 Weighted Mean Depth (WMD) 분석을 수행하였다. WMD는 각 분류군의 수직 분포 중심을 나타내는 지표로, 다음 공식을 사용하여 계산하였다:
WMD = Σ(ni × di) / Σni
(ni = 수심 i에서의 개체수 밀도, di = 수심 i의 평균 깊이)
3. 결 과
환경 요인
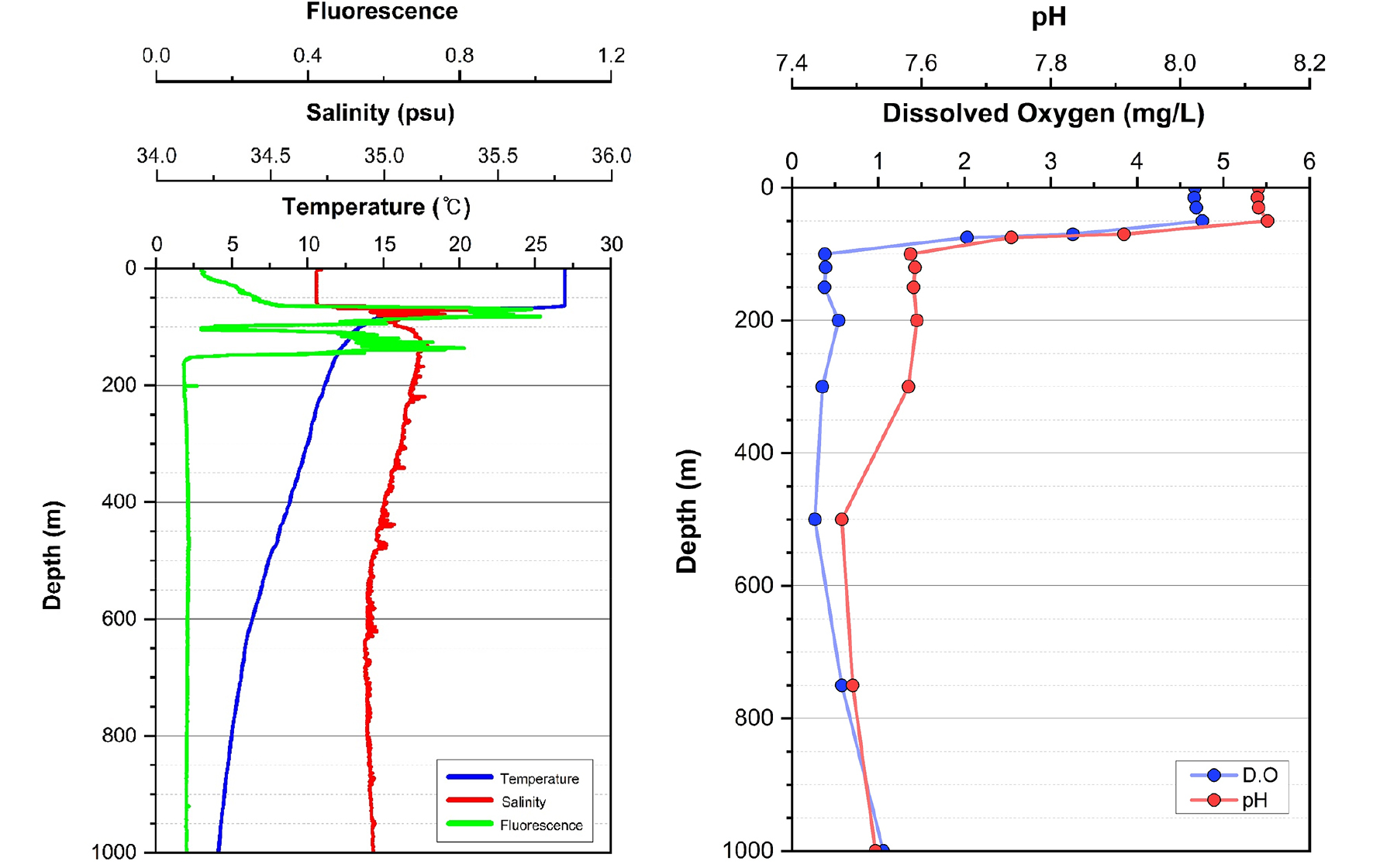
수온은 표층에서 27.0°C로 시작해 수심이 증가함에 따라 점차 감소하였으며, 특히 60–80 m 사이에서 뚜렷한 수온약층(thermocline)이 형성되었고, 1,000 m까지 수온은 약 4°C로 낮아졌다(Fig. 2). 염분은 100–200 m 구간에서 최대 35.6 psu에 도달하며 뚜렷한 염분약층을 형성하였다(Fig. 2). 형광값(엽록소 농도)은 수심 50–150 m 사이에서 두 번의 아표층 엽록소 최대층(Subsurface Chlorophyll Maximum, SCM)을 형성하였으며, 첫 번째는 70–80 m 수심에서, 두 번째는 130–140 m 수심에서 각각 관찰되었다. 용존산소와 pH는 수심에 따른 유사한 변화 양상을 나타냈으며, 두 변수 모두 표층에서 가장 높은 값을 보였고 수심이 깊어질수록 감소하는 경향을 보였다(Fig. 2). 특히, 75–500 m 사이에서는 뚜렷한 저산소층(Oxygen Minimum Zone, OMZ)이 관찰되었다.
영양염(인산염, 질산염, 규산염)은 표층에서 낮고 수심이 증가할수록 농도가 높아지는, 대양에서의 전형적인 분포 패턴을 보였다(Fig. 3). 암모늄은 100 m와 500 m 깊이에서 각각 4.1 μM과 2.4 μM의 최대치를 보였다. 입자성 유기물(POC, PON)은 표층에서 높은 농도를 보였으며, 특히 75 m 깊이에서 최대값(POC: 9.0 μM, PON: 1.2 μM)을 기록했다(Fig. 3).
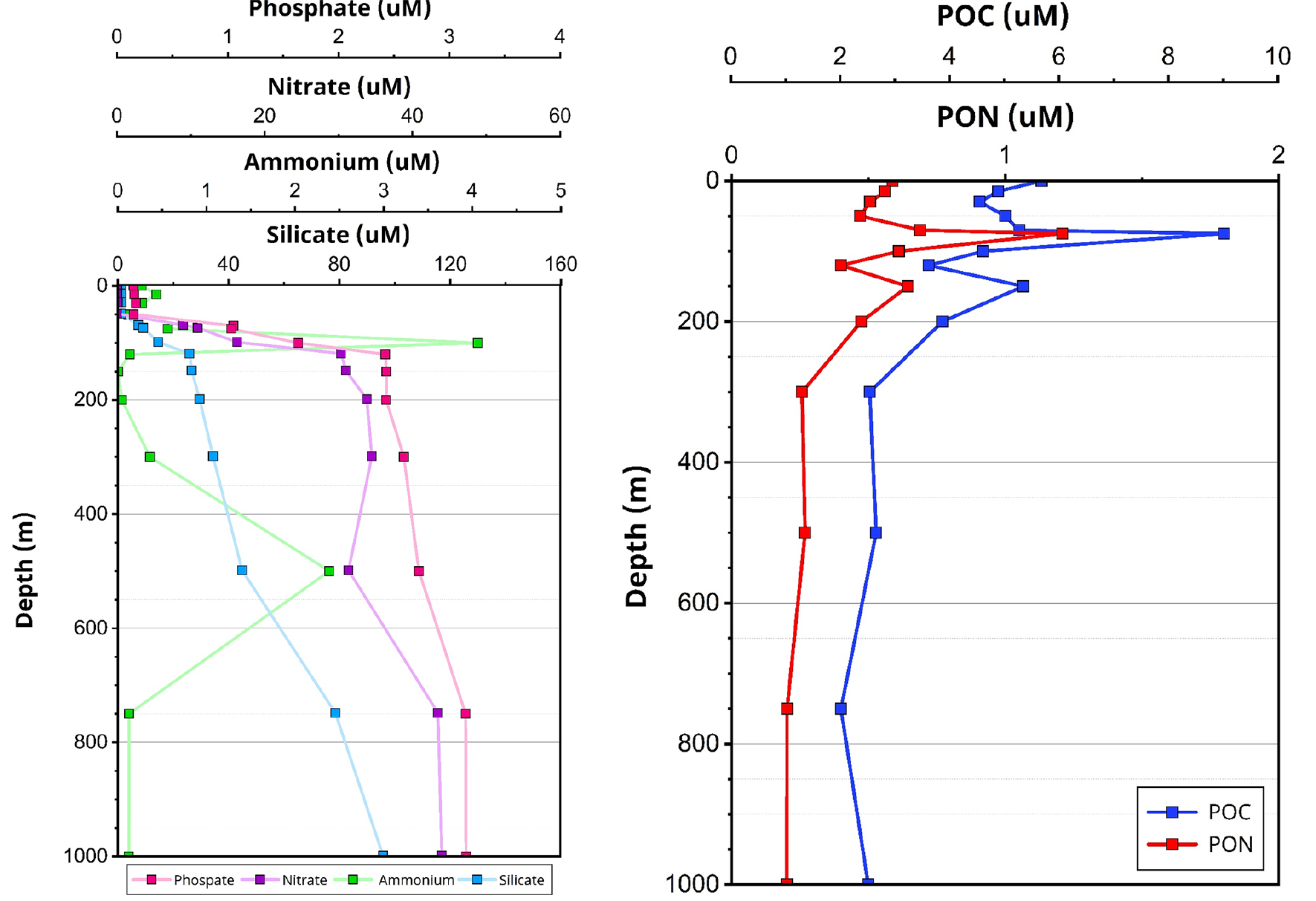
Fig. 3.
Vertical profiles of nutrient concentrations and particulate organic matter at the sampling station. Left panel: Concentrations of phosphate (μM, pink), nitrate (μM, purple), ammonium (μM, green), and silicate (μM, light blue). Right panel: Concentrations of particulate organic carbon (POC, μM, blue) and particulate organic nitrogen (PON, μM, red).
수층별 동물플랑크톤의 현존량과 탄소량
연구 해역에서 동물플랑크톤의 전체 현존량과 탄소량은 수심에 따라 뚜렷한 변화를 보였으며, 주간과 야간에 상이한 분포 양상을 나타냈다(Fig. 4). 주간에는 표층에서 가장 높은 현존량이 관찰되었고, 수심이 증가함에 따라 점진적으로 감소하는 경향을 보였다. 최대 현존량은 0–50 m 수층에서 171 개체/m3로 기록되었으며, 100 m 이하에서는 급격히 감소하여 500 m 이하에서는 1 개체/m3 미만으로 낮아졌다. 야간에는 주간과 다른 분포 양상이 관찰되었으며, 특히 상층부에서 두드러진 차이를 보였다. 최대 현존량은 50–100 m 수층에서 222 개체/m3로 기록되었으며, 이는 주간에 동일 수층에서의 현존량보다 약 68% 증가한 수치였다. 반면, 0–50 m 표층에서는 134 개체/m3로 주간보다 감소하였다.
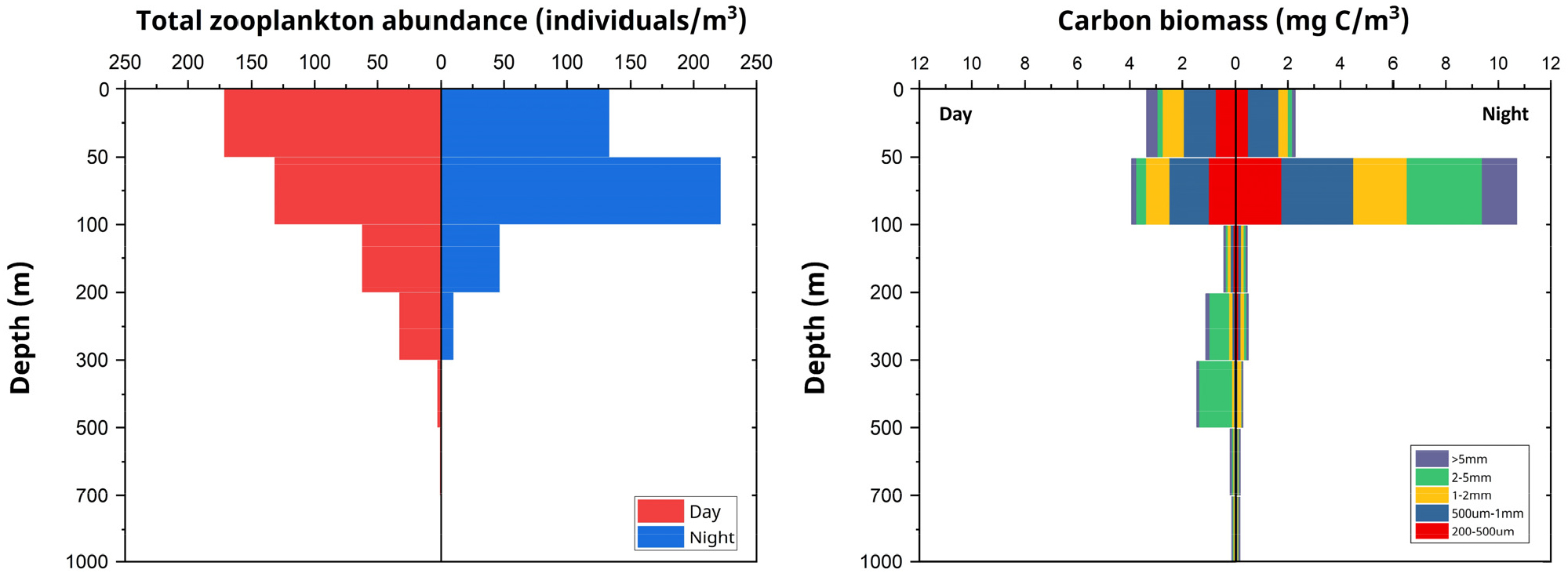
Fig. 4.
Vertical profiles of total zooplankton abundance and size-fractionated carbon biomass at the sampling station. Left panel: Total zooplankton abundance (individuals/m3) during day (red) and night (blue). Right panel: Carbon biomass (mg C/m3) of different zooplankton size fractions (0.2–0.5 mm, 0.5–1 mm, 1–2 mm, 2–5 mm, and > 5 mm) during daytime and nighttime
동물플랑크톤의 탄소량 수직 분포는 현존량 수직 분포와 유사한 경향을 보였으나, 크기별로 차이를 나타냈다(Fig. 4). 주간에는 0–50 m 수층에서 각 크기 분류군의 탄소량 합이 3.4 mg C/m3이었으며, 50–100 m 수층에서는 4.0 mg C/m3로 최대값을 기록하였다. 100–200 m 수층에서는 탄소량이 급격히 감소하여 0.44 mg C/m3의 낮은 값을 보였다. 반면, 야간에는 50–100 m 수층에서 10.9 mg C/m3의 높은 탄소량이 관찰되었는데, 이는 주간 같은 수층 대비 약 2.7배 높은 값이었다. 크기 그룹별로 분석한 결과, 0.2–0.5 mm, 0.5–1 mm 및 1–2 mm 그룹은 주야간 모두 0–100 m 수층에 집중적으로 분포하였다. 2–5 mm 그룹은 주야간에 뚜렷한 수직 분포 차이를 보여 주간에는 더 깊은 수층에 우세하게 분포하며 300–500 m 수층에서 최대 1.2 mg C/m3의 값을 기록하였다. 반면, 야간에는 상층부로 분포 중심이 이동하여 50–100 m 수층에서 최대 2.9 mg C/m3를 나타냈다. 마지막으로 5 mm 이상 크기 그룹은 다른 크기 그룹에 비해 전반적으로 낮은 탄소량을 보였으나, 야간 50–100 m 수 층에서 상대적으로 높은 값을 기록하였다.
현존량과 탄소량 모두에서 관찰된 주야간 수직 분포 차이는 통계적으로 유의미했으며(p < 0.05), 특히 표해수대에서 가장 뚜렷하게 나타났다.
동물플랑크톤 분류군별 수직 분포
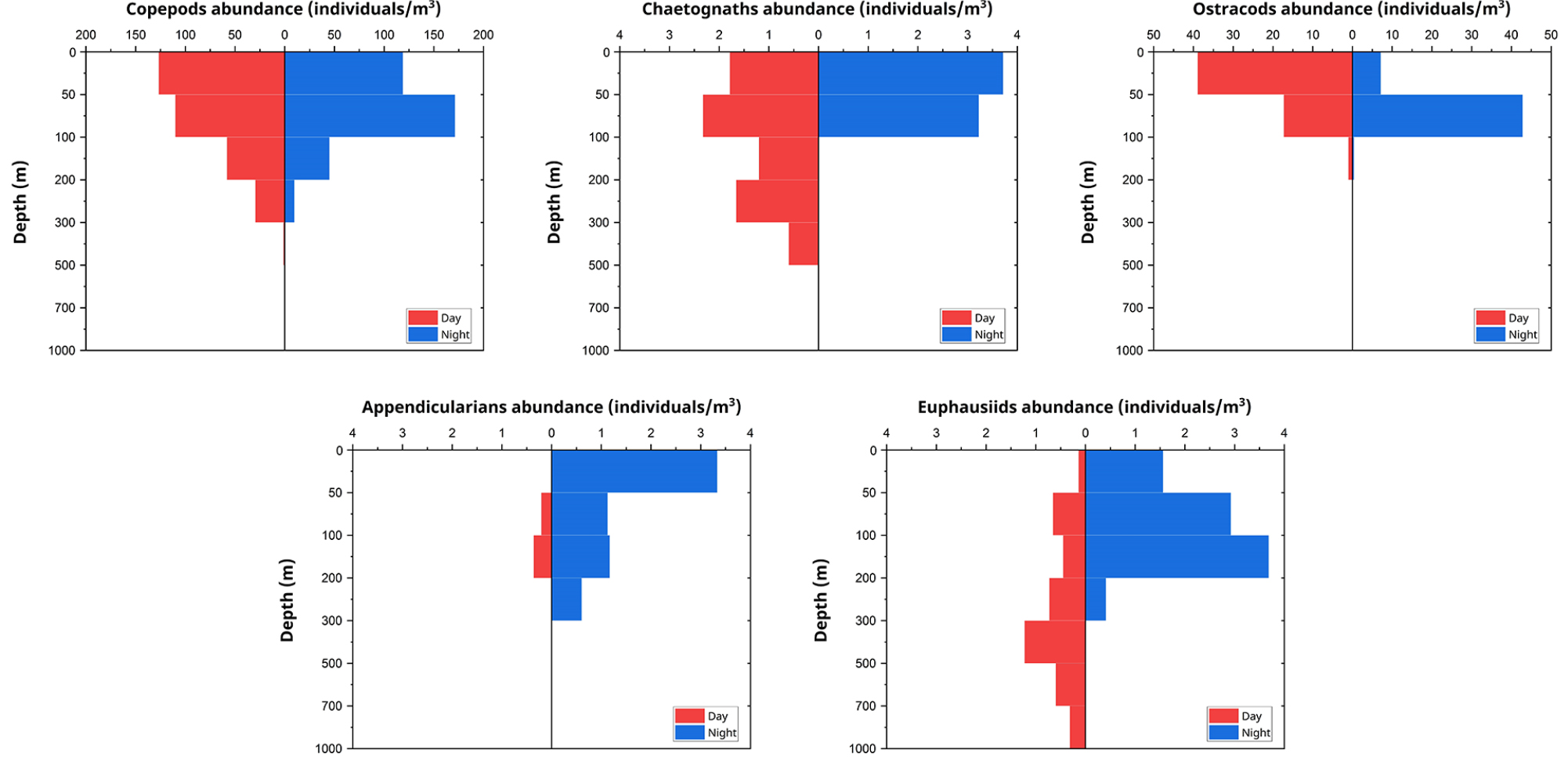
본 연구에서 조사된 정점에서는 동물플랑크톤이 5개의 주요 분류군(요각류, 모악류, 난바다곤쟁이류, 패충류, 유형류)이 출현하였다(Fig. 5). 분류군 간 수직 분포의 차이는 통계적으로 유의미했으며(ANOVA, p < 0.05), 특히 요각류와 다른 분류군 간에 뚜렷한 차이가 관찰되었다.
요각류는 전체 수층에서 가장 우점한 분류군으로, 특히 0–100 m에서 높은 현존량을 보였다. 주간에는 0–50 m 수층에서 127 개체/m3, 야간에는 50–100 m 수층에서 171 개체/m3로 최대 현존량을 기록하였다. 수심이 증가함에 따라 현존량은 급격히 감소하여 700–1,000 m 수층에서는 1 개체/m3 미만의 매우 낮은 값을 보였다. 이 수층에서 요각류의 현존량은 전반적으로 낮았으며, 주야간 현존량 차이는 유의미하지 않았다(p > 0.05). 그러나 700–1,000 m 수층에서 전체 동물플랑크톤 군집 내 요각류의 구성비는 주간에 48%, 야간에 84%로, 주야간에 큰 차이를 나타냈다.
패충류는 주로 표층에서 높은 현존량을 보였으며, 수심이 깊어질수록 현존량이 급격히 감소하는 경향을 보였다. 주간에 최대 현존량은 0–50 m 수층에서 39 개체/m3, 야간에는 50–100 m 수층에서 43 개체/m3로 나타나, 주야간 수직 분포에 차이를 보였다. 200 m 이하에서는 현존량이 급격히 감소했으며, 300 m 이하에서는 거의 발견되지 않았다.
난바다곤쟁이류는 주야간 뚜렷한 수직 분포 차이를 보였다. 주간에는 300–500 m 수층에서 최대 현존량(1 개체/m3)이 기록되었으며, 이 수층에서 전체 동물플랑크톤의 39%를 차지하였다. 반면, 야간에는 100–200 m 수층에서 4 개체/m3로 가장 높은 현존량을 나타냈으나, 해당 수층에서 전체 동물플랑크톤의 8%만을 차지하여 주간보다 상대적으로 낮은 비율을 보였다. 또한, 난바다곤쟁이류는 700–1,000 m의 깊은 수층에서도 관찰되었는데, 주간에는 이 수층에서 전체 동물플랑크톤의 52%를 차지해 우점 분류군으로 나타났으나, 야간에는 동일 수층에서 0.2%로 급감하여 뚜렷한 주야 수직 분포 차이를 보였다.
모악류와 유형류는 상대적으로 낮은 현존량을 보였으나, 각각 특징적인 분포 양상을 나타냈다. 모악류는 주간에 200–300 m 수층에서 최대 현존량(2 개체/m3, 5%)을 보인 반면, 야간에는 0–50 m 수층에서 최대 현존량(4 개체/m3, 3%)을 나타내 주야간 뚜렷한 수직 분포 차이를 보였다. 유형류는 주간에 거의 관찰되지 않았으나, 야간에 0–50 m 수층에서 최대 현존량(3 개체/m3, 3%)을 기록하였다.
요각류의 수직 분포
본 연구에서 출현한 주요 요각류 속(Genus)은 Clausocalanus, Corycaeus, Cosmocalanus, Euchaeta, Oithona, Oncaea, Paracalanus, Xanthocalanus로 확인되었다. 요각류의 수직 분포는 다양한 양상으로 나타났으며(Fig. 6), 속 간의 수직 분포 차이는 통계적으로 유의미했으며(One- way ANOVA, p < 0.05), 주야간 수직 분포 차이는 속에 따라 다양하게 나타났다. 이에 따라 요각류는 주야간 수직 분포 양상에 따라 다섯 가지 그룹으로 분류할 수 있었다.
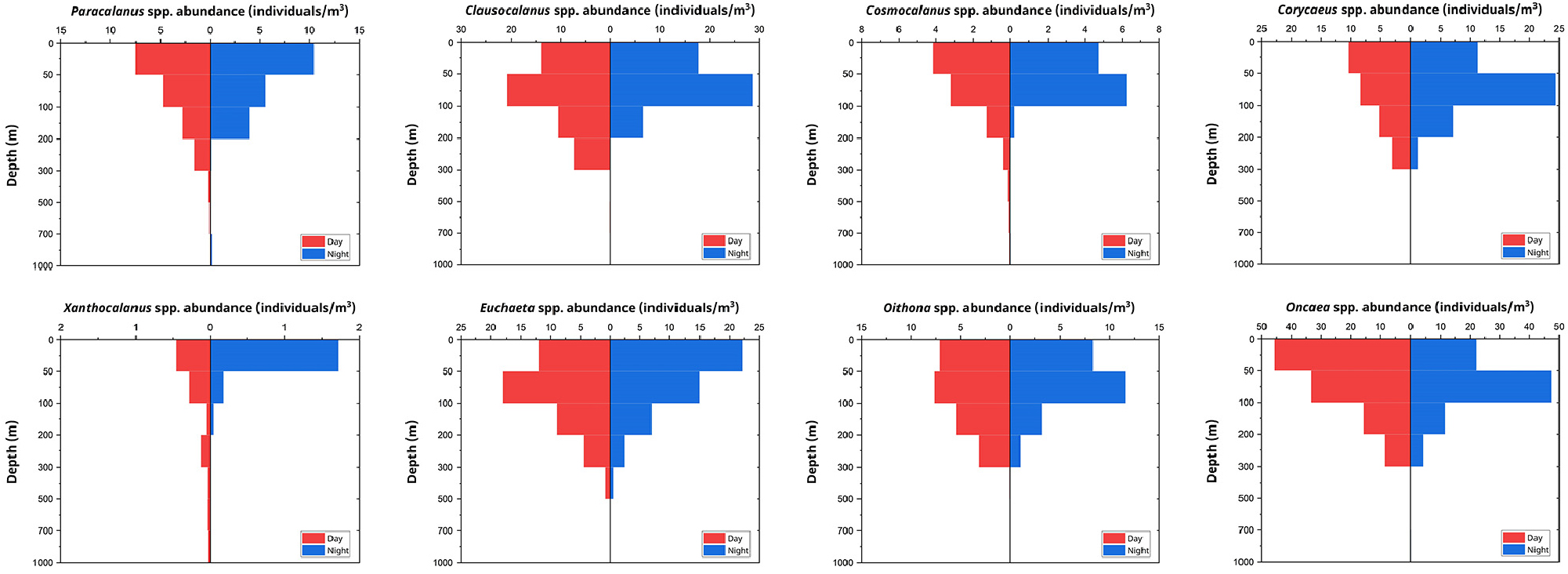
Fig. 6.
Vertical distribution of dominant copepod genera at the sampling station. The panels show abundance (individuals /m3) for Paracalanus spp., Clausocalanus spp., Cosmocalanus spp., Xanthocalanus spp., Euchaeta spp., Oithona spp., Corycaeus spp., and Oncaea spp. during day (red) and night (blue)
첫 번째 그룹은 Cosmocalanus, Corycaeus, Oncaea 속 요각류로 구성되었다. 이 그룹은 주간에는 0–50 m 수층에서 가장 높은 현존량을 보였으며, 수심이 깊어질수록 현존량이 감소하는 경향을 나타냈다. 반면 야간에는 50–100 m 수층에서 가장 높은 현존량이 관찰되었다. 특히 Oncaea 속은 요각류 중 우점 속으로, 주간에는 0–50 m 수층에서 최대치(46 개체/m3), 야간에는 50–100 m 수층에서 최대 현존량(47 개체/m3)의 현존량을 보였다.
두 번째 그룹은 Euchaeta 속으로, 첫 번째 그룹과는 반대되는 수직 분포 양상을 보였다. 야간에는 0–50 m 수층에서 22 개체/m3로 현존량이 가장 높고, 수심이 깊어질수록 현존량이 감소하는 경향을 나타낸 반면, 주간에는 50–100 m 수층에서 가장 높은 현존량(18 개체/m3)을 보였다.
세 번째 그룹은 Paracalanus 속으로, 0–50 m 수층에서 주야간 모두 가장 높은 현존량(주간: 8 개체/m3, 야간: 10 개체/m3)을 보였으며, 수심이 깊어질수록 현존량이 감소하는 경향을 나타냈다.
네 번째 그룹은 Clausocalanus와 Oithona 속으로 구성되었으며, 이 두 속은 주야간 모두 50–100m 수층에서 최대 현존량을 보였다. Clausocalanus 속은 50–100 m 수층에서 주간에 21 개체/m3, 야간에 29 개체/m3의 최대 현존량을 나타냈으며, Oithona 속도 같은 수층에서 주간에 8 개체/m3, 야간에 12 개체/m3의 현존량을 보였다.
마지막으로 Xanthocalanus 속은 다른 속들과는 달리 독특한 수직 분포 양상을 보였다. 이 속은 전반적으로 낮은 현존량을 보였으나, 주간에는 광범위한 수층에 걸쳐 분포하는 경향을 보였고, 야간에는 0–50 m 수층에서 가장 높은 현존량(2 개체/m3)을 기록하였다.
4. 토 의
동물플랑크톤 주야 수직 분포 양상
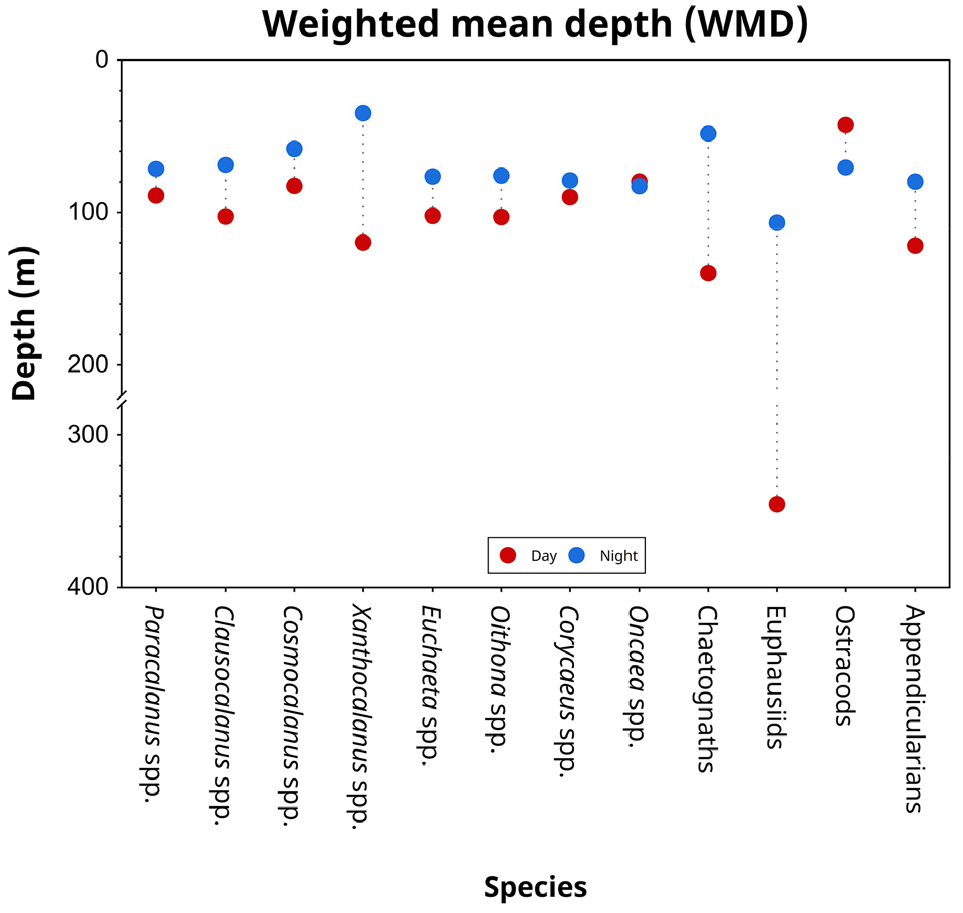
본 연구에서 관찰된 난바다곤쟁이류의 뚜렷한 주야간 수직 분포 차이(WMD: 주간 346 m, 야간 107 m; Fig. 7)는 기존 연구에서 보고된 광범위한 수직 이동 특성과 일치한다(Strömberg and Spicer 2000; Piccolin et al. 2020; Bahlburg et al. 2023). 이러한 결과는 이들의 뛰어난 운동 능력과 환경 적응력을 반영하며, 해양 생태계 내에서 다양한 생태학적 의미를 지닌다. 첫째, 개체군 수준에서 이러한 수직 이동은 생존과 에너지 획득을 최적화하는 전략이다. 난바다곤쟁이류는 주간에 깊은 수층으로 이동하여 포식 위험을 줄이고, 야간에는 상층부로 이동해 섭식 활동을 한다(De Robertis et al. 2000; Schmidt et al. 2011). 이 행동은 포식 압력과 먹이 가용성 사이의 균형을 유지하며, 개체군의 생존율과 에너지 효율을 높인다. 둘째, 난바다곤쟁이류의 강한 일주 수직 이동은 해양생태계의 수직적 물질 순환, 특히 생물학적 펌프를 통한 탄소 수송에 중요한 역할을 한다(Steinberg and Landry 2017). 본 연구의 탄소량 분석 결과, 난바다곤쟁이류가 포함된 2–5 mm 크기의 동물플랑크톤이 주야간 뚜렷한 변동을 보였다. 주간에는 300–500 m 수층에서 탄소량 최대값(1.2 mg C/m3)이 나타났으나, 야간에는 50–100 m 수층에서 최대값(2.9 mg C/m3)이 관찰되었다(Fig. 4). 이는 난바다곤쟁이류가 능동적 또는 수동적 수송을 통해 상당량의 유기탄소를 심층으로 전달하며, 이러한 과정이 표층의 탄소와 에너지를 심해로 이동시키거나 공급하는 중요한 기작임을 시사한다(Werner et al. 2014).
모악류 역시 뚜렷한 주야간 수직 분포 차이(WMD 값: 주간 140 m, 야간 48 m; Fig. 7)를 보였으며, 이는 이들의 복잡한 포식자-피식자 관계와 밀접하게 연관되어 있다. 본 연구에서 관찰된 모악류의 야간 분포 양상은 이들의 주요 먹이 생물인 요각류와 난바다곤쟁이류의 분포와 일치하며(Terazaki 2000), 이는 먹이 생물들의 높은 밀도를 효과적으로 활용하기 위한 이동 전략으로 해석될 수 있다. Ohman et al. (1983)의 연구와도 일치하는 결과로, 그들은 모악류의 일일 섭식률이 야간에 최대 3배까지 증가한다고 보고했다. 이러한 섭식률 증가는 먹이 생물들이 야간에 상층에 집중되는 시기와 모악류의 주야간 수직 분포 차이가 시간적, 공간적으로 일치함을 보여준다. 반면, 주간에 더 깊은 수층으로 이동하는 행동은 시각적 포식자를 피하기 위한 전략으로 해석된다(Roe 1984). 또한, Thuesen and Childress (1993)는 일부 모악류 종들이 깊은 수층의 낮은 산소 농도에 적응하여 대사율을 낮출 수 있다고 보고했다. 이는 주간에 에너지를 절약하고, 야간의 활발한 섭식 활동을 위한 에너지를 보존하는 데 도움이 되는 전략으로 작용할 수 있다.
요각류 중 주야 수직 분포의 가장 뚜렷한 차이를 보인 Xanthocalanus 속(WMD 값: 주간 120 m, 야간 35 m; Fig. 7)은 앞서 언급한 환경 요인에 대한 적응 전략과 유사한 맥락에서 이해될 수 있다. 이 요각류 속은 주로 중층에서 심층에 걸쳐 서식하며(Grice and Hulsemann 1970), 일부 종은 1,000 m 이상의 깊은 수심에서도 발견된다(Markhaseva and Schulz 2006). Xanthocalanus 속의 먹이 선호도는 이들의 수직 분포와 밀접한 관련이 있으며, Nishida and Ohtsuka (1996)는 이 속이 주로 식물성 쇄설물이나 해중설(marine snow)을 섭식한다고 보고했다. 이들이 야간 0–50m 수층에 집중되는 것은 새롭게 형성된 식물성 쇄설물이나 그 전구체에 접근하기 위한 전략으로 해석될 수 있다. 반면, 주간에 더 깊은 수층에 분포하는 것은 시각적 포식자로부터 피식 위험을 줄이는 동시에, 침강 중인 해중설을 지속적으로 이용할 수 있는 이점이 있다.
Oncaea 속과 Corycaeus 속 요각류는 주야간 수직 분포 양상의 차이가 거의 나타나지 않았는데, 주된 이유는 이들의 형태적, 행동적 특성에 있다. Oncaea 속은 대부분의 시간을 정지 상태로 보내며(Paffenhöfer 1993; Titelman and Fiksen 2004), 이러한 낮은 운동성은 에너지 소비를 최소화하면서도 포식자를 효과적으로 회피해 큰 폭의 수직 이동 없이도 생존할 수 있게 한다. 반면, Corycaeus 속은 Oncaea 속과는 다른 생존 전략을 가지고 있다. Corycaeus 속은 매우 활동적인 포식자로, 빠른 돌진 운동을 통해 먹이를 포획한다(Gophen and Harris 1981). 이들은 짧은 거리를 빠르게 이동한 후 정지하는 ‘급속 이동-정지’ 패턴을 반복하며, 이는 에너지를 효율적으로 사용하면서도 포식자를 회피하는 데 효과적일 수 있다(Landry et al. 1985). 이러한 특성은 Corycaeus 속이 큰 폭의 수직 이동 없이도 효과적으로 먹이를 포획하고 포식자를 회피할 수 있게 해주며, 결과적으로 제한된 수직 범위 내에서 성공적인 생존과 번식을 가능하게 한다.
Corycaeus 속의 생식 전략 또한 이들의 수직 분포와 관련이 있을 수 있다. Corycaeus 속을 포함한 Corycaeidae 과의 요각류는 알 주머니를 몸에 부착한 채로 생활하며, 이 전략은 수직 이동 중 알의 손실 위험을 줄이고 안정적인 수직 분포를 유지하는 데 기여할 수 있다(Boxshall and Halsey 2004; Turner 2004). 또한, 알 주머니를 보호하는 행동은 포식자로부터 알을 보호하고 생존율을 높이는 데 도움이 될 수 있다(Mauchline 1998). 이러한 생식 전략은 Corycaeus 속이 큰 폭의 이동 없이도 효과적으로 번식할 수 있는 중요한 요인 중 하나로 해석될 수 있다.
패충류에서 관찰된 주야 수직 분포 양상(WMD 값: 주간 42 m, 야간 71 m)은 다른 종들과는 상반된 특징을 보였다(Fig. 7). 이는 포식자 회피 가설(predator avoidance hypothesis)로 설명될 수 있으며, 이 가설에 따르면 일부 동물플랑크톤은 주요 포식자의 일주기적 행동과 반대되는 수직 분포 양상을 보여 포식 압력을 줄일 수 있다(Zaret and Suffern 1976; Ohman et al. 1983; Cohen and Forward 2009). 또한, 이러한 분포 전략은 시각적 포식자가 아닌 촉각 포식자를 회피하는 데 효과적일 수 있다(Lampert 1993).
환경 요인과 동물플랑크톤 수직 분포의 관계
본 연구에서는 CCFZ 해역에서 동물플랑크톤의 주야간 수직 분포와 이에 영향을 미치는 환경 요인 간의 관계를 분석하였다. 동물플랑크톤의 수직 분포는 수온, 용존산소, 엽록소 농도 등의 환경 요인과 밀접하게 관련되어 있었으며, 이러한 환경 요인에 따라 각 분류군의 주야간 수직 분포 양상이 달라지는 것을 확인할 수 있었다.
수온은 동물플랑크톤의 분포를 결정짓는 가장 중요한 요인 중 하나로 밝혀졌으며, 뚜렷한 수온약층은 동물플랑크톤의 수직 분포 범위를 제한할 것으로 여겨진다. 이는 수온약층에서의 급격한 수온 변화로 인해 유영 능력이 약한 동물플랑크톤에게는 물리적 장벽으로 작용하면서, 이들의 생리적 수온 내성 범위를 벗어나는 환경 조건을 형성하기 때문이다(Mackas et al. 1993; Deary et al. 2015). 예를 들어, Oncaea 속 요각류와 패충류는 상대적으로 따뜻한 수온 조건을 선호하는 표층 적응 종으로(Figs 2 and 6), 이들은 수온약층 위의 높은 수온 환경에 잘 적응되어 있지만, 수온약층 아래의 낮은 수온에서는 생존하기 어려울 수 있다. 반면, Euchaeta 속 요각류, Xanthocalanus 속 요각류, 그리고 유형류 등은 수온 변화에 크게 의존하지 않거나, 다양한 수온 조건에 적응할 수 있는 능력을 보여준다(Figs 2 and 6). 이는 Wishner et al. (2013)의 연구 결과와 일치하며, 수온 구배가 동물플랑크톤의 생리적 내성 범위와 대사 속도에 영향을 미쳐 이들의 수직 분포를 결정한다는 주장을 뒷받침한다. 또한, 수온은 동물플랑크톤의 발생 속도, 성장률, 생식 활동 등 생활사 전반에 걸쳐 중요한 영향을 미치며, 각 종의 최적 서식 수온 범위가 이들의 수직 분포를 결정하는 핵심 요인임을 시사한다(Huntley and Lopez 1992; Titelman and Fiksen 2004; Yebra et al. 2009).
용존산소 역시 동물플랑크톤 분포를 특징짓는 중요한 환경 요인으로 나타났다. 특히, 75–500 m 깊이에서 관찰된 뚜렷한 저산소층은 일부 종의 수직 분포 범위를 제한하는 요인으로 작용할 수 있다. 용존산소 농도가 낮은 환경에서는 많은 동물플랑크톤 종이 호흡에 필요한 충분한 산소를 얻기 어려워 대사 활동과 운동 능력이 저하될 수 있다(Ekau et al. 2010). 예를 들어, 소형 요각류인 Oithona similis와 Oncaea 속 요각류는 저산소 환경에 취약하여 이러한 수층에서 낮은 밀도로 관찰되는 경향이 있다(Wishner et al. 2013). 대신 이들은 높은 용존산소 농도와 일차생산성이 나타나는 환경, 특히 SCM 층 부근에서 높은 현존량으로 발견되어, 이들 종의 특정 환경 선호도를 명확히 보여준다. 그러나 난바다곤쟁이류와 Euchaeta 속 요각류는 전 조사 수층(0–1,000 m)에서 관찰되었다(Figs. 5 and 6). Euchaeta 속 요각류는 주로 0–300 m 수층에서 높은 현존량을 보였으나, 500 m 이하 수심에서도 1 개체/m3 미만의 낮은 현존량으로 관찰되었다(Fig. 6). 이러한 결과는 이들 분류군, 특히 난바다곤쟁이류가 다른 그룹과는 차별적인 환경 선호도를 지니고 있음을 나타내며, 저산소 조건을 포함한 넓은 수직 범위에서 서식할 수 있는 능력을 설명해준다. Seibel (2011)의 연구에 따르면, 일부 동물플랑크톤 종은 저산소 환경에서 헤모글로빈 유사 단백질의 발현을 증가시켜 산소 운반 효율을 높이는 적응 메커니즘을 통해 생존할 수 있다. 이러한 저산소 환경에 대한 적응은 Euchaeta 속 요각류와 난바다곤쟁이류에게 여러 생태학적 이점을 제공할 수 있다. 이들 분류군은 다른 종들이 생리적 한계로 인해 접근하기 어려운 저산소 수층에서 활동할 수 있어, 저산소 내성이 있는 미생물이나 소형 동물플랑크톤과 같은 특화된 먹이 자원을 독점적으로 이용할 수 있다(Escribano et al. 2009; Wishner et al. 2018). 또한, 저산소 환경에서는 포식 위험이 상대적으로 낮아져 생존 가능성이 높아지며, 이러한 환경은 이들의 장기적인 생존과 번식에 유리하게 작용할 수 있다(Seibel 2011; Kiko et al. 2016).
엽록소 농도(식물플랑크톤 생체량의 지표)의 수직 분포 역시 동물플랑크톤의 분포에 중요한 영향을 미치는 것으로 나타났다. 본 연구에서 관찰된 뚜렷한 SCM 층은 많은 초식성 동물플랑크톤의 분포와 일치하는 경향을 보였다. 특히, Clausocalanus 속과 Paracalanus 속 요각류는 SCM 층 부근에서 높은 현존량이 관찰되었으며(Figs. 2 and 6), 이는 이들이 SCM 층에 집중된 식물플랑크톤을 주요 먹이원으로 활용함을 시사한다(Longhurst 1985). 그러나 SCM 층 내에서도 두 요각류 속 사이에 미세한 수직 분포의 차이가 관찰되었는데, 이는 다른 환경 요인(예: 수온, 염분)에 대한 선호도의 차이를 반영하는 것으로 여겨진다(Paffenhöfer and Mazzocchi 2003; Peralba et al. 2017). 이러한 결과는 같은 SCM 층에서 관찰되더라도, 두 속이 서로 다른 생태적 전략을 취하고 있을 가능성을 제시한다.
이러한 동물플랑크톤의 수직 분포 특성은 각 분류군의 생태적 특성과 환경 적응 전략을 잘 반영하고 있다. Maas et al. (2014)의 연구에서 제시된 바와 같이, 동물플랑크톤 군집 구조는 복잡한 환경 구배에 따라 특징지어지기 때문에 수층의 물리화학적 특성에 따라 세밀하게 구조화되어 있다. 예를 들어, Euchaeta 속 요각류는 중층 및 저산소 환경을 선호하며 포식자로서의 역할을 수행하는 반면, Oncaea 속 요각류는 표층을 선호하고 부유성 유기물을 섭취하는 섭식자 역할을 한다.
이와 같이 동물플랑크톤의 다양한 주야간 수직 분포 양상은 해양 환경의 복잡성과 포식-피식 관계나 자원 경쟁, 그리고 종별 생리적 특이성 등 복합적인 영향에 의한 결과로 사료된다. 그러나, 본 연구는 CCFZ 해역에서 동물플랑크톤의 주야간 수직 분포에 대한 중요한 통찰을 제공했지만, 몇 가지 한계점이 있다. 단일 정점에서의 단기 조사로 인해 연구해역의 시공간적인 대표성이 매우 부족하며, 일부 분류군의 종 수준 동정이 이루어지지 않아 종 특이적 생태 특성 파악에 제한이 있었다.
이를 보완하기 위해, 향후 연구에서는 광역조사와 장기 모니터링을 통해 동물플랑크톤 군집의 시공간적 변동성을 파악하고, DNA 메타바코딩 등의 분자생물학적 기법을 활용하여 종 다양성을 더 정확히 평가할 필요가 있다(Kobari et al. 2008; Longhurst 2010). 이러한 노력은 CCFZ 생태계의 생물다양성에 대한 이해를 향상시키고, 궁극적으로 이 독특한 해양생태계의 지속 가능한 관리와 보존에 기여할 것으로 기대된다(Smith et al. 2008; Levin et al. 2020).
5. 결 론
본 연구는 북동태평양 클라리온-클리퍼톤 균열대(CCFZ)에서 동물플랑크톤의 주야간 수직 분포와 그에 영향을 미치는 환경 요인을 조사하였다. 연구 결과, 동물플랑크톤은 복잡하고 다양한 수직 분포 양상을 보였으며, 특히 난바다곤쟁이류, 모악류, 일부 요각류 속에서 뚜렷한 주야간 수직 분포 차이가 관찰되었다. 이러한 분포 차이는 수온, 용존산소, 엽록소 농도 등의 환경 요인과 밀접하게 연관되어 있으며, 각 분류군의 생태적 특성과 적응 전략을 반영하고 있다. 특히 본 연구해역에서도 능동적 탄소 플럭스(Active carbon flux)의 주요 매개체로서 중요한 역할을 하는 것으로 추정할 수 있다.
또한, 이번 연구는 CCFZ에서 상대적으로 연구가 부족했던 중층표영대 동물플랑크톤의 주야간 수직 분포를 조사하여 이들의 생태적 역할에 대한 이해를 확장하는 데 기여하였다. 이러한 연구 결과는 CCFZ의 지속 가능한 관리와 보존을 위한 기초 자료로 활용될 수 있으며, 기후 변화와 향후 심해 채광 등의 인간 활동이 해양 환경에 미칠 잠재적 영향을 평가하는 데 중요한 과학적 근거를 제공할 것으로 기대된다.