1. 서 론
2. 연구 방법
재료 및 시약
열수 초음파 추출
리파아제 활성 저해능 측정
세포 생존율 측정
지방전구세포 배양 및 분화 유도
지방전구세포 분화 억제능 측정
항비만 mRNA 발현 측정
통계분석
3. 연구 결과
리파아제 활성 저해능 측정
지방전구세포 성장저해 평가
지방전구세포 분화 억제능 평가
지방전구세포 분화 유전자 발현에 미치는 영향
4. 결 론
1. 서 론
질병관리청의 국민건강영양조사에 따르면 비만은 제2형 당뇨병, 고혈압, 심혈관계 질환 및 암과 같은 만성질환의 원인으로서 국내의 성인 비만 유병률은 2009년 29.7%에서 2019년 33.8%로 증가 추세에 있어 비만 예방 및 치료가 절실한 실정이다(Farhad et al. 2020; Kim et al. 2021). 비만 치료법으로는 주로 식이요법을 병행한 운동요법이 권장되나 불규칙한 식생활 습관으로 지속적인 운동이 어려운 현대인의 특성으로 인해 과잉 영양분 섭취를 제한하기 위한 식욕억제제와 지방흡수억제제 등의 약물 치료제 개발이 진행되고 있으며 그 중 중성지방을 2-모노글리세라이드와 지방산으로 가수분해하는 리파아제의 활성을 억제하는 항비만 소재에 관한 연구와 개발이 주목받고 있다(Young et al. 2021). 대표적으로 미국 식품의약국(United States Food and Drug Administration)의 승인을 받아 시판 중인 리파아제 활성 저해제인 orlistat는 췌장의 리파아제 활성 부위와 경쟁적으로 결합해 효소-기질 복합체 형성을 방해하여 중성지방의 가수분해를 저해함으로써 섭취한 지방의 체내 흡수를 감소시켜 항비만 효과를 나타낸다(Abou et al. 2019). 그러나 장기복용에 따른 위장장애, 과민증과 담즙 분비장애 등의 부작용이 보고됨에 따라 최근에는 천연물로부터 부작용 우려가 없는 비만 억제 소재 개발과 항비만 작용기전을 규명하는 연구가 활발히 진행되고 있다(Zaidatul et al. 2021).
지방전구세포가 지방세포로 분화되는 과정(adipogenesis)은 에너지대사 경로를 통하여 세포 내 유입되는 포도당을 저장하며 체내 지방 축적과 지방 생성에 관여하여 비만의 발생과 밀접한 관련이 있다(Yusuke et al. 2019). 지방전구세포인 3T3-L1은 호르몬과 다양한 전사인자들의 상호작용에 의해 지방세포로 분화되어 세포 내 중성지방을 축적하는데, 지방전구세포 분화는 sterol regulatory element binding proteins-1c (SREBP-1c)에 의한 peroxisome proliferator activated receptor-γ (PPAR-γ)와 CCAAT enhancer binding protein-α (CEBP-α)의 발현이 지방산 합성 효소인 fatty acid synthase (FAS)와 stearoyl-CoA desaturase1 (SCD1)를 활성화시켜 중성지방(triglyceride, TG)의 합성을 촉진함에 따라 진행된다(Yuan et al. 2018; Ge et al. 2019). 이러한 전사인자들의 발현 조절을 통한 지방전구세포 분화 억제가 비만 예방의 중요한 전략으로 보고되고 있다.
갈조식물문(phaeophyta)에 속하는 괭생이모자반(Sargassum horneri)은 2016년 5월 식품의약품안전처에 식품 원료로 고시된 식용 갈조류로 한국, 일본 및 중국 연안에 분포하며 우리나라 동남해안과 제주도에 군락을 형성하여 폭넓게 분포하고 있다(Asanka et al. 2020). 특히 낮은 온도에서 성장하는 괭생이모자반은 6월 중순까지 군락을 형성하여 쿠로시오 해류를 따라 국내 연안으로 다량 유입되어 연안 경관을 해치고 악취를 발생시키는 1차 피해와 함께 선박 안전사고, 수산양식 시설 훼손과 양식생물 폐사 등 2차 피해를 발생시켜 심각한 환경문제와 수거비용을 발생시켜 유해 해양생물자원으로 분류되고 있어 처리 또는 활용 방안 개발에 대한 필요성이 높다(Byeon et al. 2019).
본 연구는 유해 해양생물자원인 괭생이모자반으로부터 초음파 추출을 통해 생리활성 물질을 생산하고 항비만 효과를 확인하고자 항비만 지표 중의 하나인 리파아제 활성 저해능을 측정하고 지방전구세포 분화의 주요 유전자 발현을 평가하여 항비만 작용기전을 규명하였다. 이를 통해 유해 해양생물자원을 활용한 신규 항비만 소재를 생산하여 기능성 식품 및 의약품 소재로써의 활용 기회를 높임과 동시에 해양환경 오염 방지에 기여하고자 한다.
2. 연구 방법
재료 및 시약
괭생이모자반은 2020년 제주에서 생산된 건조물을 파라제주(Jeju, Korea)에서 구매하여 4°C에서 냉장 보관하여 사용하였다. 실험에 사용된 리파아제, orlistat, 3-morpholinopropane-1-sulfonic acid, 3-isobutylmethylxanthine (IBMX), dexamethasone (DEX)와 insulin은 Sigma-Aldrich (St. Louis, MO., USA)사에서 구입하였다. 세포배양 및 분화에 사용된 시약으로 Dulbecco’s modified eagle’s medium (DMEM), new born calf serum (NBCS), fetal bovine serum (FBS), penicillin과 trypsin-EDTA는 Gibco (Rockville, MD., USA)사의 제품을 구입하여 사용하였다.
열수 초음파 추출
괭생이모자반은 열풍건조기(FC 49, Lab house, Pocheon, Korea)에서 24시간 건조하여 중량 변화가 없음을 확인하고 식품분쇄기(HMF-3000S, Hanil, Seoul, Korea)로 분쇄하여 100 mesh (0.10 mm) 이하의 분말을 회수하여 밀봉상태에서 데시케이터에 보관하였다. 괭생이모자반으로부터 생리활성 물질을 추출하기 위해 식품안전 용매인 증류수를 이용한 초음파 추출을 수행하였다. 밀폐형 유리 튜브(PYREX-1636, Scilab., Seoul, Korea)에 분말화된 시료 1 g에 증류수 10 mL를 혼합하여 초음파 추출기(SD-250H, Mujigae Co., Seoul, Korea)로 60°C에서 30분간 추출하였으며 추출물은 원심분리기(Labogene 1236R, Gyrozen Co., Daejeon, Korea)를 이용하여 5,000 rpm에서 10분간 원심분리한 후 상등액만 회수하여 실험에 사용하였다.
리파아제 활성 저해능 측정
괭생이모자반 추출물의 리파아제 활성 저해능은 Kwon 등의 방법에 따라 측정하였다(Kwon et al. 2011). 괭생이모자반 추출물에 리파아제 30 mg, 10 mM 3-morpholinopropane-1-sulfonic acid와 1 mM EDTA를 혼합하고 100 mM 인산완충용액(pH 6.8) 0.85 mL을 첨가하여 37°C에서 15분간 반응시켰다. 이후 10 mM p-nitrophenyl butyrate 0.02 mL를 가하여 15분간 반응시켜 생성된 p-nitrophenol를 분광광도계(Optizen 2120UV, Mecasys Co., Daejeon, Korea)로 410 nm에서 측정하였다. 양성대조군으로는 orlistat를 사용하였으며 괭생이모자반 추출물의 리파아제 활성 저해능은 아래와 같이 시료 첨가군과 무첨가군의 흡광도 차이를 백분율로 나타내었다.
세포 생존율 측정
실험에 사용된 지방전구세포인 3T3-L1은 한국세포주은행(KCLB, Seoul, Korea)에서 분양받았으며 괭생이모자반 추출물이 지방전구세포의 생존율에 미치는 영향을 확인하기 위해 MTT (3-(4, 5-diimethylthiazole-2-yl)-2, 5 diphenyl tetrazolium bromide) 분석을 진행하였다. 지방전구세포를 96-well-plate에 4 × 103 cells/mL로 분주하고 24시간 안정화 후 괭생이모자반 추출물을 처리하여 72시간 배양하였다. 배지를 제거한 후 0.25 mg/mL MTT를 0.1 mL 가하여 4시간 반응한 다음 생성된 포르마잔을 DMSO에 용해시켜 마이크로 플레이트 리더기(AMR-100, Allsheng Co., Seoul, Korea)로 540 nm에서 측정하였다. 괭생이모자반 추출물 처리에 의한 지방전구세포의 생존율은 아래 식에 따라 백분율로 산출하였다.
지방전구세포 배양 및 분화 유도
지방전구세포는 10% NBCS와 1% penicillin이 첨가된 DMEM을 사용하여 37°C와 5% CO2 환경의 동물세포배양기(Panasonic, Osaka, Japan)에서 72시간 배양하였다. 지방전구세포 분화 유도를 위해 세포를 T-25 cell culture flask에 3 × 105 cells/well로 분주하고 48시간 배양한 후 분화유도 배지(10% FBS, 0.5 mM IBMX, 1 mM DEX와 1 μg/mL insulin)를 처리하여 48시간 분화를 진행하였다. 이후 10 μg/mL insulin이 첨가된 10% FBS-DMEM으로 교체하고 분화유도 96시간부터는 48시간 간격으로 10% FBS-DMEM으로 교체하면서 분화를 유도하였다.
지방전구세포 분화 억제능 측정
괭생이모자반 추출물이 지방전구세포 분화 억제에 미치는 효과를 확인하기 위해 지방세포 내 지방구를 선택적으로 염색하는 Oil red O 염색을 수행하였다. 분화가 완료된 지방세포의 배지를 제거한 후 10% 포르말린을 첨가하여 지방세포를 1시간 고정시킨 후 인산완충용액으로 3회 세척한 다음 Oil red O로 15분간 염색하였다. 염색 후 Oil red O를 제거하고 증류수로 3회 세척한 다음 광학현미경(Benulux B.V., Breda, Netherlands)으로 염색된 지방구를 확인하였다. 또한 생성된 지질의 정량 분석을 위해 염색된 지방구에 99.8% 이소프로판올을 가하여 Oil red O를 용출시켜 분광광도계로 497 nm에서 흡광도를 측정하였다.
항비만 mRNA 발현 측정
분화가 완료된 지방전구세포를 인산완충용액으로 세척한 후 Accuprep® universal RNA extraction kit (Bioneer, Daejeon, Korea)를 사용하여 전체 RNA를 추출하였다. 추출된 RNA (1 µg)에 cDNA synthesis 완충용액과 cDNA synthesis enzyme mix를 혼합한 뒤 역전사 반응을 수행하였으며 cDNA를 주형으로 항비만 핵심 유전자인 SREBP-1c, CEBP-α, PPAR-γ, FAS와 SCD1를 증폭하였다(Table 1). 유전자 증폭을 위한 reverse transcription-polymerase chain reaction (RT-PCR) 반응 조건은 95.0°C 5분간 초기변성 후 95°C에서 30초간 변성반응, 59°C에서 30초간 결합반응 및 72°C에서 30초간 연장반응으로 구성하였으며 증폭과정은 총 35회 수행하였다. 각각의 RT-PCR 결과물은 GelRed® nucleic acid gel stain (Komabiotech, Seoul, Korea)을 포함하는 1.5% 아가로스 겔에서 전기영동 후 Quantity one software (Bio-Rad, CA, USA)로 발현도를 수치화하였다.
Table 1.
Primer sequences used in reverse transcription-polymerase chain reaction (RT-PCR) of major genes related to obesity
| Obesity-realated genes | Forward (5’-3’) | Reverse (5’-3’) |
| SREBP-1c1) | CCATGCTGGAACTGATGGAG | CTGAACTGTGTGACCCAGCC |
| PPAR-γ2) | GGTTTAGGGATGTTTGGGTTTT | AAGCCCACTTCATTTCATTGGT |
| CEBP-α3) | AGCCGAGATAAAGCCAAACAAC | GAATCTCCTAGTCCTGGCTTGC |
| FAS4) | CCCTGAAATCCCAGCACTTC | GGCATGGCTGCTGTAGGGGT |
| SCD15) | CGACATGCTCGGCCTCATAG | GCCAGAAGCCCCCAAGAAAC |
| β-actin | AGCACAGAGCCTCGCCTTT | CTTAATGTCACGCACGATTTCC |
통계분석
모든 실험은 3회 반복 수행하여 결과값을 평균±표준편차로 표시하였으며 GraphPad Prism Software (San Diego, CA, USA)을 사용하여 통계 처리하였다. 두 실험군 간 유의성 검정은 independent t-tests를 사용하여 각 실험군 간의 유의성을 분석하였고, p < 0.05를 기준으로 통계적 유의성을 검정하였다.
3. 연구 결과
리파아제 활성 저해능 측정
중성지방이 리파아제에 의해 지방산과 모노글리세리드로 분해되면 담즙산과 함께 미셸을 형성하여 소장의 융털 상피세포에서 점막세포 내로 흡수되고 지방세포에 축적되어 비만이 유발된다(Jackman et al. 2020). 따라서, 리파아제 활성을 억제하면 중성지방 분해가 방지되어 중성지방의 소화 및 흡수율이 감소하여 항비만 효과를 기대할 수 있다. 괭생이모자반으로부터 초음파를 이용해 추출된 생리활성 물질의 리파아제 활성 저해능을 측정한 결과 60.4%로 확인된 반면 양성대조군인 orlistat가 57.9%로 측정되어 괭생이모자반 추출물은 orlistat보다 높은 리파아제 활성 저해능을 나타내었다. 또한, Jung 등이 감태 추출물의 리파아제 활성 저해능을 평가한 결과인 19.1% 보다 3배 가량 우수해 괭생이모자반이 천연 리파아제 저해제로서의 활용 가능성이 높다는 것을 입증하였다(Jung et al. 2011). 상업화된 비만 치료제 중 리파아제 저해제의 일종인 orlistat는 중성지방의 구조 유사체로써 기질-효소 복합체 형성을 방해하는 대항제(antagonist)로 작용하여 중성지방 가수분해를 저해하는 것으로 알려져 있는데, 괭생이모자반 추출물도 리파아제의 활성부위와 효소-기질 복합체를 형성함으로써 중성지방의 분해를 저해하여 항비만 효과를 나타낸다고 사료된다(Katimbwa et al. 2021).
지방전구세포 성장저해 평가
괭생이모자반 추출물이 지방전구세포 지방구 축적 저해와 항비만 유전자 발현에 미치는 영향을 평가하기에 앞서 지방전구세포에 대한 세포 성장 억제농도를 확인하기 위해 3T3-L1을 대상으로 추출물을 농도별로 처리하여 세포 생존율을 조사하였다(Fig. 1). 괭생이모자반 추출물을 0.0~4.0 mg/mL로 처리하였을 때 추출물의 농도가 지방전구세포 생존율에 유의한 영향을 미침을 확인하였다(p < 0.05). 괭생이모자반 추출물을 1.0 mg/mL로 처리하였을 때 대조군 대비 세포 생존율이 91.4% (p = 0.0638)로 측정되어 유의적으로 세포를 저해하지 않는 것으로 확인된 반면, 2.0 mg/mL 이상에서는 세포 생존율을 감소시켜 1.0 mg/mL 이하에서 지방전구세포 생존율에 영향 없음이 확인되었다. 이는 차전초 추출물을 지방전구세포에 1.0 mg/ mL로 처리하였을 때 세포 생존율이 20.0%로 보고된 Jeon 등의 결과에 비해 높은 값으로 괭생이모자반 추출물이 지방전구세포에 대한 세포 독성을 보이지 않음을 확인할 수 있었다(Jeon et al. 2014). 따라서 Oil red O 염색을 이용한 지방전구세포 분화 억제능과 항비만 유전자의 발현 평가 실험을 위한 괭생이모자반 추출물 농도를 1.0 mg/mL 이하로 결정하여 세포 독성을 보이지 않는 수준에서 실험을 수행하였다.
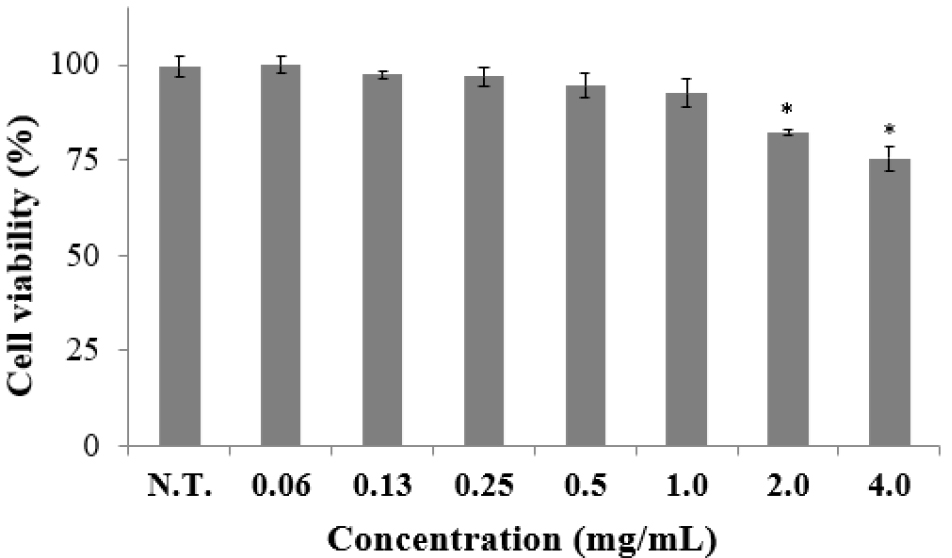
Fig. 1.
Effect of S. horneri extracts (0.0~4.0 mg/mL) on the cell viability in 3T3-L1 preadipocyte. The values were calculated as a percentage compared to the control group where the extract was not treated. Bars represent the mean±standard deviation of three independent experiments and Bars marked with asterisks are significantly different from the control (*p < 0.05)
지방전구세포 분화 억제능 평가
지방전구세포로부터 분화된 지방세포는 인지질 단일막에 의해 둘러싸인 중성지방인 지방구를 형성하여 Oil red O에 의해 선택적으로 염색된다(Hwang et al. 2019). 본 연구에서는 괭생이모자반 추출물이 지방전구세포 분화에 미치는 영향을 평가하기 위해 Oil red O 염색을 수행하여 세포 내 중성지방이 축적된 정도를 확인하였다. 지방전구세포에 괭생이모자반 추출물을 0.25, 0.5와 1.0 mg/mL로 처리하여 분화를 유도한 뒤 지방세포 내 축적된 지방구를 Oil red O로 염색하여 세포 내 중성지방의 축적을 비교하였을 때, 괭생이모자반 추출물 처리군에서 대조군 대비 각각 11.4, 19.7과 25.6%로 지방구 축적이 감소됨을 확인하였다(p < 0.05; Fig. 2). 이는 Kang 등이 도라지 및 울금 추출물을 지방전구세포에 처리하였을 때 1.0 mg/mL 이상에서 지방구 축적이 감소하였다고 보고한 결과와 일치하는 결과이다(Kang et al. 2015). 따라서 괭생이모자반 추출물이 지방세포 내 지방구 형성 억제를 통한 지방축적의 감소에 효과적임을 확인하였으며 지방축적 감소와 관련된 항비만 작용기전 확인을 위해 지방전구세포 분화에 관여하는 핵심 유전자 발현 분석이 추가적으로 필요할 것으로 사료된다.
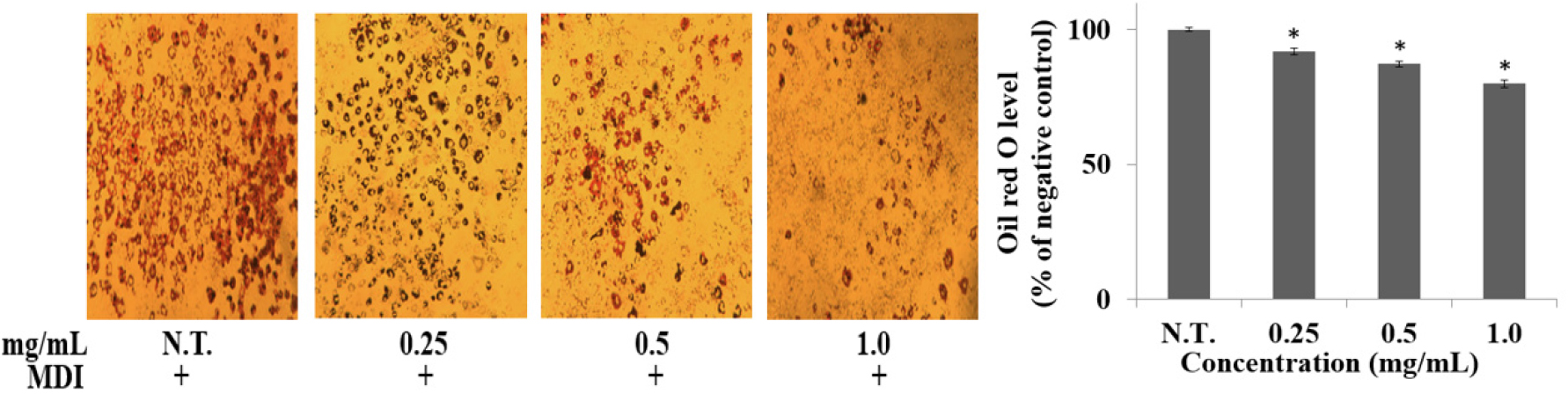
Fig. 2.
Inhibitory effect of S. horneri extract on preadipocyte differentiation and lipid accumulation of 3T3-L1 preadipocyte. Preadipocyte differentiation was initiated with MDI (0.5 mM IBMX, 1 mM DEX, and 1 μg/mL insulin) in 3T3-L1 treated with S. horneri extract. After 8 days, lipid droplets in adipocyte were fixed and stained with Oil red O (original magnification 64.0X). Bars marked with asterisks are significantly different from the control (*p < 0.05)
지방전구세포 분화 유전자 발현에 미치는 영향
지방전구세포가 지방세포로 분화되는 과정에서 괭생이모자반 추출물이 분화 관련 주요인자인 SREBP-1c, PPAR-γ, CEBP-α, FAS와 SCD1 mRNA 발현에 미치는 영향을 평가하고자 RT-PCR을 수행하였다(Fig. 3). 지방전구세포에 괭생이모자반 추출물의 첨가 농도는 앞선 실험에서 가장 높은 지방구 생성 저해율을 나타낸 1.0 mg/mL로 처리하였으며 SREBP-1c, PPAR-γ, CEBP-α, FAS와 SCD1의 발현이 대조군 대비 각각 65.2, 54.9, 50.0, 33.8과 33.8%로 나타나 분화 관련 주요인자가 모든 실험군에서 유의적으로 감소됨을 확인하였다(p < 0.05). 특히 SREBP-1c 발현이 65.2%로 가장 높게 억제되었는데, SREBP-1c는 지방전구세포의 분화 초기 단계에서 지방산 대사와 지질 생합성에 관여하는 유전자들의 발현을 조절하는 상위조절 인자로 보고된다(Fang et al. 2019). 따라서 괭생이모자반 추출물이 지방전구세포 분화에 중추적인 역할을 담당하고 있는 SREBP-1c의 발현을 억제함으로써 PPAR-γ와 CEBP-α 발현에 영향을 미쳐 하위 유전자인 FAS와 SCD1 등의 발현 억제를 통한 지방전구세포 분화 억제 및 지방구 생성 억제 효과를 나타낸 것으로 사료된다.
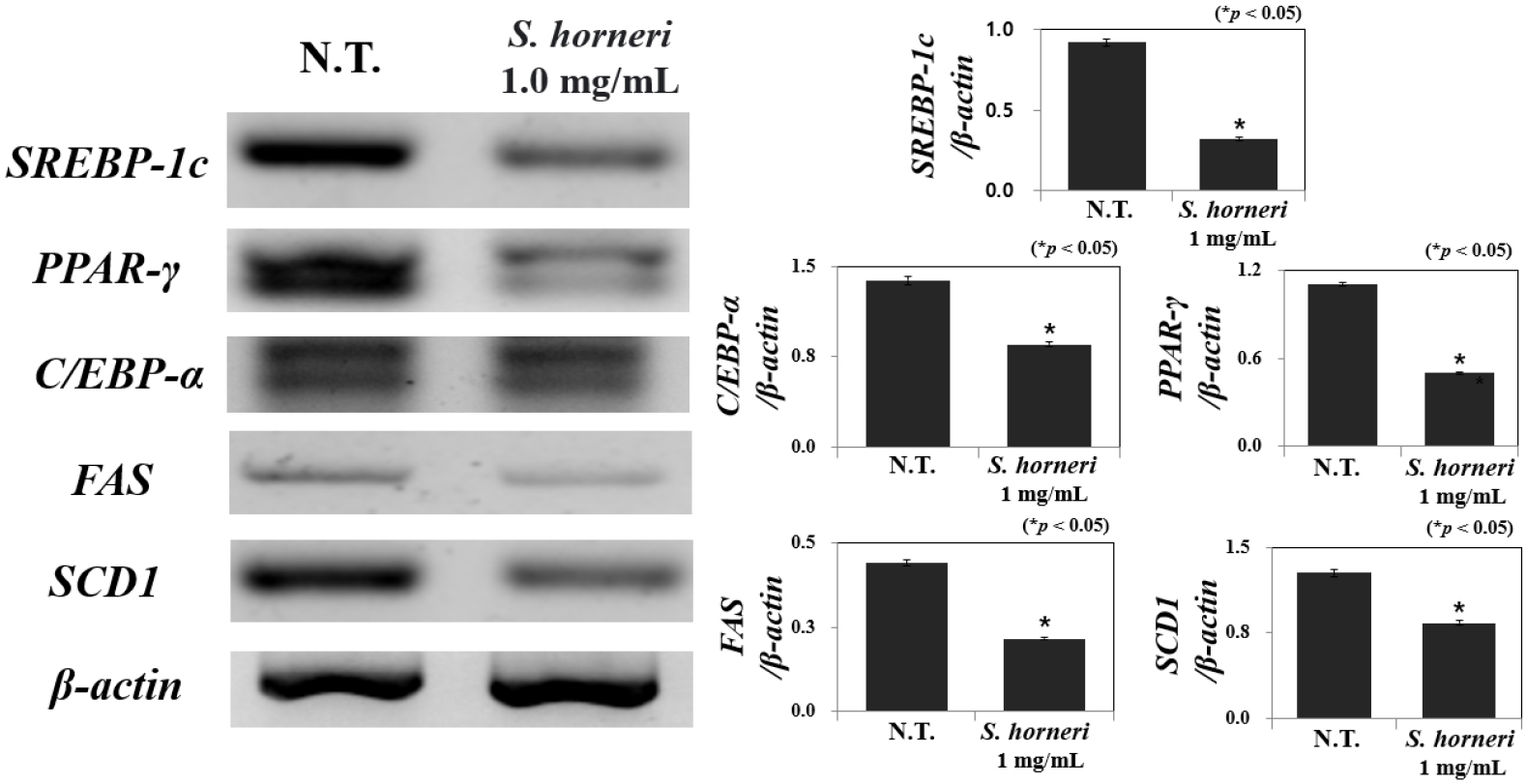
Fig. 3.
Effect of S. horneri extract on SREBP-1c, CEBP-α, PPAR-γ, FAS, and SCD1 mRNA expression levels in 3T3-L1. The statistical analysis of the data was conducted by a t-test. Values are expressed as mean±standard deviation of three experiments. Bars marked with asterisks are significantly different from the control (*p < 0.05)
지방전구세포 분화에 따라 축적되는 중성지방은 지방생성 관련 유전자 또는 신호 전달물질의 상위조절 기전에 의해 증감이 결정된다고 알려져 있으며 괭생이모자반의 갈산 지표성분은 지방전구세포 분화 조절인자인 PPAR-γ 발현을 억제하여 지방구 축적을 감소시키는 것으로 밝혀져 있다(Aranaz et al. 2019). 이에 괭생이모자반 추출물은 PPAR-γ와 CEBP-α의 상위 유전자인 SREBP-1c 억제를 통해 전사인자인 PPAR-γ와 CEBP-α 활성을 감소시킴이 확인되어 보다 효과적인 항비만 작용 후보물질로 가치를 지닌다고 할 수 있다.
4. 결 론
본 연구는 괭생이모자반 추출물의 항비만 활성을 검증하고자 리파아제 활성 저해능과 지방전구세포 분화 억제효과를 평가하였다. 괭생이모자반 추출물의 리파아제 활성 저해능은 68.1%로 확인되어 중성지방 분해 감소를 통한 항비만 효과를 확인하였다. 괭생이모자반 추출물의 지방구 생성 억제효과를 확인하기 위해 지방전구세포에 무독한 농도인 0.25, 0.5와 1.0 mg/mL로 추출물을 처리하였을 때 대조군 대비 각각 11.4, 19.7과 25.6%로 농도 의존적으로 지방구의 형성이 억제되는 것을 확인하였다. 이를 바탕으로 괭생이모자반 추출물이 항비만 유전자인 SREBP-1c, PPAR-γ, CEBP-α, FAS와 SCD1 발현에 미치는 영향을 평가하였을 때 전사인자의 발현이 대조군 대비 각각 65.2, 54.9, 50.0, 33.8과 33.8%로 유의적으로 감소됨이 확인되어 괭생이모자반 추출물이 상위조절 인자인 SREBP-1c 발현을 중심으로 항비만 기전을 조절함으로써 후속 조절인자의 발현을 감소시켜 지방전구세포 분화를 억제함이 입증되었다. 이러한 연구 결과에 기반할 때, 유해 해양생물자원인 괭생이모자반으로부터 리파아제 활성 저해 및 지방전구세포 분화를 억제시킴으로써 항비만 효능을 보유한 건강 기능성 식품 및 의약품 소재로서의 활용 가능성을 확인하였다. 향후 괭생이모자반의 초음파 가공법에 따른 기능성 증진 연구와 더불어 생리활성 성분의 체중조절과 관련된 약리작용기전을 동물실험을 통해 명확하게 규명하는 것이 필요하다고 사료된다.




