1. 서 론
2. 재료 및 방법
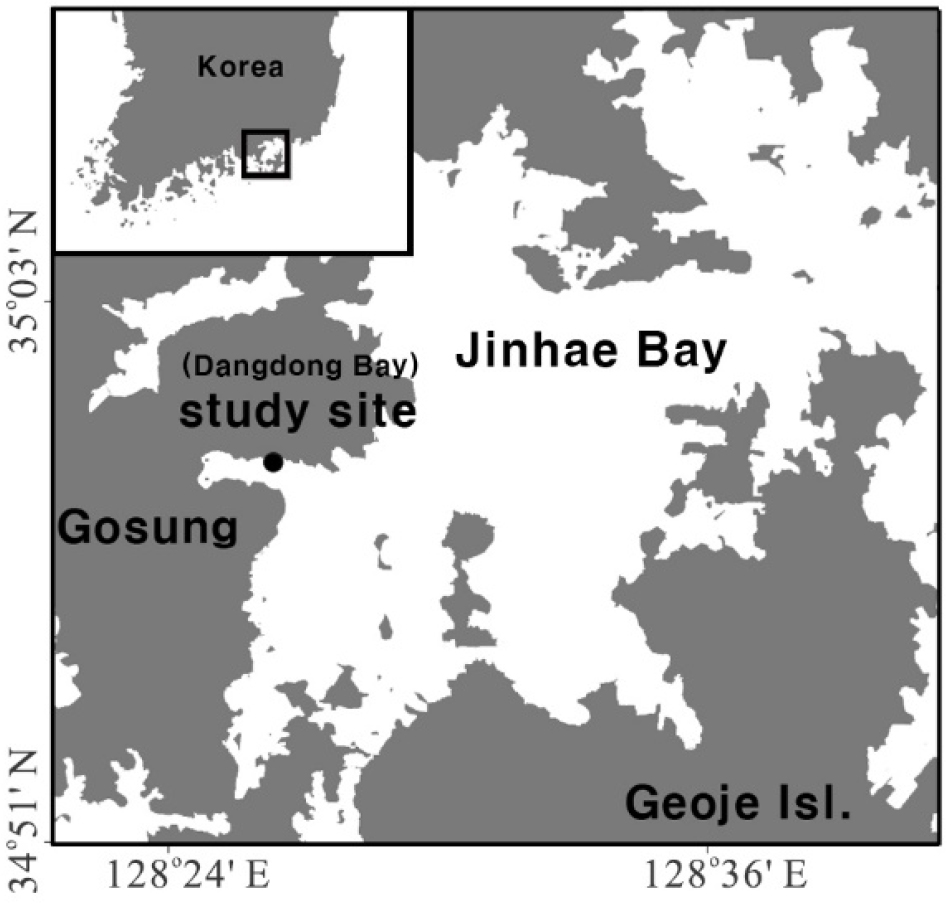
연구지역
시료채집
수층 메탄 농도 분석
퇴적층 내 용존가스(O2, H2S)농도 분석
퇴적층-수층 메탄 플럭스 측정
수층-대기 메탄 플럭스 계산
퇴적층-수층 산소소모율 계산
3. 결 과
진해 당동만 수층의 환경요인 및 메탄농도 변화
퇴적물 내 용존산소 및 황화수소의 수직분포
진해 당동만의 산소 및 메탄 flux 변화
4. 토 의
빈산소 형성에 따른 shoaling 양상 변화
빈산소에 의한 퇴적층-수층 플럭스 와 수층-대기 플럭스 변화
진해만 수층-대기 메탄 플럭스 평가
1. 서 론
주요 온난화 원인 물질인 메탄의 대기 농도는 최근에 크게 증가하는 양상을 보이고 있다(Ruddiman 2003; Nisbet et al. 2014; Dean et al. 2018). 해양이 대기 메탄 증가에 미치는 영향을 평가한 연구는 많지 않으나, 대륙붕과 연안 지역에서 해양 메탄 생산이 주로 이루어진다고 알려져 있다. 대륙붕과 연안은 면적은 해양의 15%에 불과하나, 해양 메탄 배출량의 75%를 차지하는 것으로 추정된다(Bange et al. 1994). 단위면적당 메탄 생성은 육상에 비해 적은 편이나, 최근 연구에 의하면 부영양화의 정도에 따라 일부 지역에서는 매우 높을 수 있음이 보고되었다(Middelburg et al. 2002; Torres-Alvarado et al. 2005; Reeburgh 2007; Gelesh et al. 2016; Dean et al. 2018).
연안환경에서 메탄은 주로 퇴적층에서 일어나는 유기물의 혐기성 분해과정으로 생성된다(Torres-Alvarado et al. 2005). 생성된 메탄은 호기성 산화(Aerobic methane oxidation, MOx) 또는 혐기성 메탄산화(Anaerobic Oxidation of Methane, AOM)에 의해 일부 소비된 후 수층으로 방출된다(Reeburgh 2007). 산소 포화도가 높은 수층으로 이동된 메탄은 주로 호기성 산화에 의해 제거되고 나머지는 대기로 방출된다(Middelburg et al. 2002; Torres-Alvarado et al. 2005; Steinle et al. 2017). 기본적으로 메탄생성은 혐기성 유기물 분해 과정이고 메탄의 소비는 호기성 호흡이 가장 효율적이기 때문에 수증의 산소 농도에 민감하게 좌우된다(Torres-Alvarado et al. 2005; Steinle et al. 2017). 저층의 빈산소(< 63 µmol L-1)는 부영양화에 의한 산소소모 증가와 성층으로 인한 산소공급의 저해가 복합적으로 일어날 때 발생한다(Rabalais et al. 1991; Turner et al. 2006). 최근 연안 부영양화가 증가하면서 빈산소 현상 또한 점차 증가하고 있음이 보고되고 있다(Diaz and Rosenberg 2008; Keeling et al. 2009; Friedrich et al. 2014; Steinle et al. 2017). 이러한 빈산소 현상은 연안메탄 생성에 영향을 줄 수 있다(Rabalais et al. 1991; Turner et al. 2006).
퇴적층으로 유입된 유기물은 호기·혐기성 미생물 대사작용에 의해 빠르게 분해된다. 저층 산소농도가 풍부한 환경에서는 퇴적물로 유입된 유기물의 대부분이 호기성 미생물에 의해 분해되는 반면, 빈산소 환경에서는 호기성 미생물에 의한 유기물 분해 보다는 혐기성 유기물 분해과정에 의해 유기물 분해가 주도된다. 이는 호기성 유기물 분해 구간의 축소를 야기하며, 혐기성 유기물 분해를 표층퇴적물과 가까운 좀 더 얕은 곳에서 일어나게 만든다(shoaling; Middelburg and Levin 2009; Gelesh et al. 2016). 메탄생성과정은 유기물의 혐기성 분해과정 중 최종단계로서 일반적으로 가장 깊은 곳에서 일어나게 되며, shoaling은 메탄생성과정을 좀 더 얕은 곳에서 일어날 수 있도록 만들 수 있다(Froelich et al. 1979; Torres-Alvarado et al. 2005; Gelesh et al. 2016). 이는 퇴적층 표면에서 메탄 생성구간까지의 거리가 짧아짐을 뜻하므로 결과적으로 메탄 생성구간에 유입되는 유기물을 증가시켜 메탄생성을 촉진시킬 가능성이 있다. 또한 생성된 메탄의 수층으로의 이동거리가 짧아지기 때문에 shoaling은 퇴적층에서 산화에 의한 메탄 제거를 감소시킬 수 있다(Middelburg and Levin 2009; Gelesh et al. 2016). 생성 증가와 제거 감소의 복합적인 작용은 퇴적층-수층 메탄 플럭스(sediment-water methane flux, Fsw)를 증가시키는 원인이 될 수 있을 것이다.
연안에서 빈산소와 메탄의 상관관계에 대한 연구 사례는 많지 않으나 빈산소에 의한 수층 용존 메탄 증가가 보고된 바 있다(Bange et al. 2010; Gelesh et al. 2016). 다른 연구에서는 빈산소시 수층 내 메탄의 산화 역시 같이 증가할 수 있음을 보였는데, 이러한 생산과 제거 기작의 동반 증가가 메탄 플럭스의 증가를 억제하였고, 결과적으로 빈산소 시기에도 메탄 플럭스 증가가 나타나지 않았다(Steinle et al. 2017). 본 연구에서는 빈산소와 메탄 플럭스의 상관관계를 확인하기 위해 계절적 성층화의 발생으로 인해 빈산소가 나타나는 진해만 당동만(Kim et al. 2012)에서 빈산소에 따른 메탄 플럭스의 변동을 정량화하고자 하였다.
2. 재료 및 방법
연구지역
진해만은 남해 동쪽 해안에 위치하고 있는 평균 수심 20 m 내외의 반폐쇄성 내만이다(Fig. 1). 담수 유입은 적은 편이며, 주로 가덕수로(Fig. 1)를 통해 제한적인 해수 교환이 일어나 육상에서 유입된 유기물이 외해로 방출되기 어려운 환경으로서, 높은 영양염 농도와 조류 대발생 등 부영양화 증상이 나타나는 지역이다. 영양염 과다 공급으로 인한 조류 대발생은 산소 소모를 증가시키고, 여름철 성층 강화로 인한 저층 산소 공급의 저해와 맞물려 빈산소의 원인이 된다(Kim et al. 2012). 진해만의 빈산소는 매년 발생하고 있으며 점차 확장되는 추세를 보인다(Lee et al. 2018). 연구지역인 당동만은 진해만의 서북부에 위치한 평균수심 13 m의 반폐쇄성 내만으로 진해만에 위치한 내만 중 하나이다(Fig. 1). 당동만에서 발생하는 빈산소와 그 영향은 진해만 대부분을 차지하는 중앙부 지역과 일치하는 결과를 보인다(Shin et al. 2015).
시료채집
진해만은 5월에 성층이 강화되면서 빈산소가 시작되며, 7–8월에 강화/유지된 후 9월에 성층이 사라지는 “사발 모양의 저층산소 농도 변화” (“An’s Bowl”; Lee et al. 2017)를 나타낸다. 따라서 본 조사의 시료 채취 시기(2019년 4월, 5월, 8월, 11월)는 각각 빈산소 형성 전(4월), 빈산소 형성기(5월), 빈산소 시기(8월), 빈산소 해소기(11월)를 대표한다.
메탄분석에 사용되는 수층 시료는 조사 선상에서 5 L 니스킨 채수기를 이용해 수심별(0 m, 3 m, 6 m, 9 m, 12 m, 13.5 m)로 채취하였다. 시료는 니스킨 채수기에 고무튜브를 연결해 160 ml serum vial에 보관되었으며 4일 이내에 분석되었다. 수층의 현장 특성(온도, 염분, 용존산소 등) 은 Hydrolab® (4월, 5월, 8월)과 YSI® (11월)을 이용하여 표층에서부터 2 m 간격으로 조사되었다. 수층-퇴적층 플럭스(sediment-water interface flux)를 측정하기 위한 퇴적물은 아크릴 코어(지름 4 cm, 높이 20 cm)를 이용하여 스쿠버 다이버가 교란되지 않은 시료를 직접 채취하였다. 현장 상태를 유지한 퇴적물 코어는 채집 후 2–3시간 이내에 현장조건과 동일한 온도로 유지되는 실험실의 배양기에서 유지되었다. 퇴적물 특성 측정은 1–5 cm 간격으로 자른 퇴적물 이용하였으며, 공극률, 입도 등을 측정하였다. 퇴적물 코어는 현장 온도에서 1–3일간 배양되었으며, 시간에 따른 용존 메탄 농도의 변화는 퇴적층-수층 메탄 flux 계산에 이용되었다.
수층 메탄 농도 분석
용존 메탄 농도는 헤드스페이스(headspace) 분석법(Kampbell and Vandegrift 1998)으로 측정되었다. 3-way 밸브가 부착된 air-tight Hamilton 주사기를 이용하여서 초고순도 He기체(160 ml 용기의 경우 25 ml 헤드스페이스; 60 ml 용기의 경우, 15 ml 헤드 스페이스 이용)를 시료 병에 주입하였고, 헤드스페이스와 수층 간 평형을 이루도록 24시간 이상 상온 보관하였다. 헤드스페이스 내 기체의 메탄농도는 가스크로마토그래피(Gas Chromatography; Hewlett Packard 5890 S. Ⅱ, GC)를 이용하여 측정되었다. 운반기체인 He을 통해 칼럼으로 분리되어 불꽃이온화 검출기(Flame Ionization Detector, FID)에 의해 감지된 메탄 신호는 컴퓨터와 연결된 DA converter를 통해 기체 내 메탄 농도를 나타내는 peak area로 전환되었다. 메탄농도의 계산은 5.1 ppm 표준메탄(Research Institute of Gas Analysis Science, RIGAS)과의 비교를 통해 정량화 되었다. 메탄의 농도가 높을 경우 정량적인 희석을 통해 표준메탄농도 이하로 낮추어 측정하였다. 각 실험은 3번 반복되었으며 수괴의 용존메탄은 headspace 내 메탄의 농도를 이용하여 수괴의 온도와 염분을 고려하여 정량화 되었다 반복측정에서 표준오차(SE)는 0.5% 이내이다.
퇴적층 내 용존가스(O2, H2S)농도 분석
퇴적물 깊이에 따른 공극수 내 산소와 황화수소 농도는 산소미세전극과 황화수소 미세전극 시스템을 이용하여 고해상도(수직 측정간격 < 100 µm)로 측정되었다(Lee at al. 2003). 산소미세전극은 전극(Unisense®OX-50)의 직경 약 50 µm이고 반응속도가 0.3초 이하였다. 전극의 검량은 산소 농도가 0(Ascorbate 산 용액으로 생성)과 100% 포화(현장 온도에서 포화)된 해수의 전류값을 이용하였다(Rasmussen and Jørgensen 1992; Hwang and Cho 2005). 황화수소 미세전극은 Unisense®가 제공하는 type Ⅱ (H2S- 100)의 전극을 사용하였다(반응속도 < 10초). 전극의 검량은 황화수소농도가 0 과 100 µM의 황화수소 용액을 이용하여 이루어졌다. 각 미세전극은 micromanipulator (Unisense®, MM33)에 고정된 후 automatic motor와 profiling program을 이용하여 50 µm 간격으로 삽입되었다. 깊이에 따른 용존가스 농도 변화는 미세전극에 연결된 picoammeter (Unisense®, PA2000)에 나타난 전류값을 이용하여 계산하였다. 측정된 깊이별 용존산소 농도 변화는 퇴적층 산소소모율(sediment oxygen demand, FO2)을 계산하는데 사용되었다.
퇴적층-수층 메탄 플럭스 측정
실험실로 운반된 퇴적물 코어는 현장상태를 유지하여 1–3일간 배양되었다. 배양이 끝난 후 주사기로 저층수를 추출하여 60 ml serum vial에 넣은 후 ZnCl2(50% w/w) 용액 50 µL를 첨가하여 고정한 뒤 밀봉하였다. 시료는 헤드스페이스 측정법을 이용하여 추출 후 1일 이내에 분석되었으며 0시간 샘플의 경우 현장에서 채집한 저층수를 사용하였다. 퇴적층에서부터 수층으로 방출되는 메탄 flux (Fsw)는 배양 시간 동안 수층 내 메탄 농도의 변화 기울기로부터 결정되었다(eq 1).
A: 코어의 단면적(cm2), Vhs: Headspace의 부피(cm3), t: 배양시간(day), CH4: 메탄농도(nM).
수층-대기 메탄 플럭스 계산
수층으로부터 대기로 방출되는 메탄 플럭스(Water-Air Methane Flux, Fwa)는 표층 메탄의 값을 수층-대기 교환식에 대입하여 계산되었다(eq 2; Bange et al. 2010).
K600: 슈미트수 600에 의해 표준화된 기체의 이동속도(cm h-1), ScCH4 :메탄의 슈미트 수, Cw: 표층수 메탄농도(nM), Ceq: 평형 CH4 농도(nM)
Ceq는 NOAA (National Oceanic and Atmospheric Administration)의 2019년 평균 자료(1874.7 ppb)를 사용하여 Yamamoto et al. (1976)의 식을 통해 계산되었다. ScCH4는 염분에 대한 비례식을 통해 계산되었다(Wanninkhof 1992, 2014). K600은 Jiang et al. (2008)이 제시한 식을 사용하여 계산하였다(eq 3).
u10: 풍속(m sec-1)
퇴적층-수층 산소소모율 계산
퇴적층-수층 산소소모율은 산소미세전극을 통해 측정한 깊이에 따른 산소농도를 이용하여 계산되었다(eq 4; Cai and Sayles 1996; Lee et al. 2003).
𝜙: 공극률, Ds: 산소의 확산계수(cm-2 sec-1), C0: 해수-퇴적물 경계면에서의 산소농도(µmol L-1), R: 순 반응률(M day-1)
퇴적층-해수 경계면은 Lee et al. (2003)이 제시한 확산경계층(Diffusive Boundary Layer, DBL) 바로 아래의 깊이로 정하였다. 퇴적층에서의 산소확산계수(Ds)는 수층에서의 산소확산계수(Dsw, cm-2 sec-1)와 공극률을 이용하여 구하였다(Archie 1942; Ullman and Aller 1982).
3. 결 과
진해 당동만 수층의 환경요인 및 메탄농도 변화
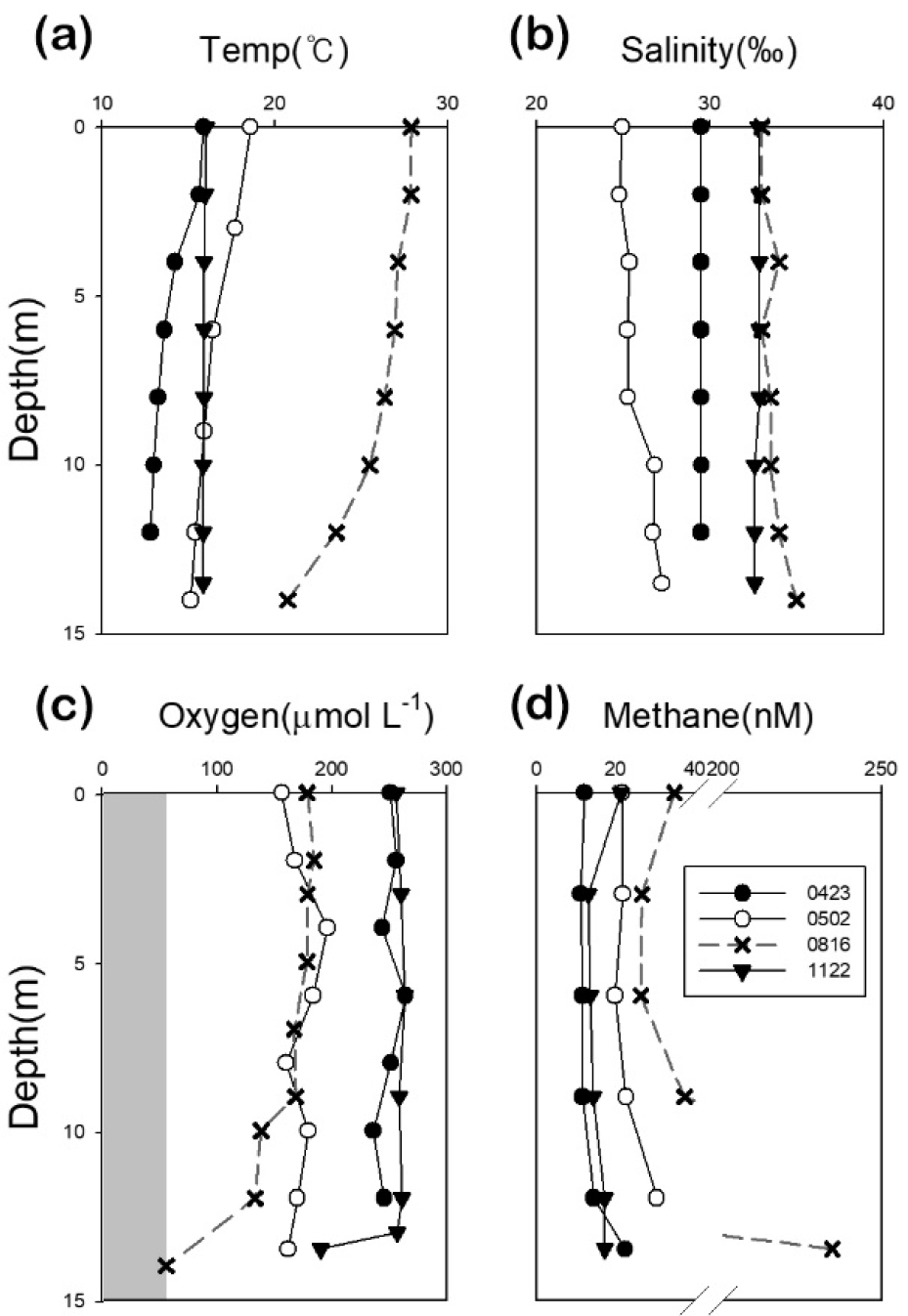
조사기간 동안 표층 수온은 16–31℃의 범위를 보이며 8월에 가장 높은 값이 나타났다(Fig. 2a). 성층의 정도를 나타내는 표층과 저층의 수온차는 5월부터 증가하다 11월 이후 감소하는 계절적 패턴을 보였다. 염분의 경우 수심 별로 큰 변화를 보이지 않았다(25–35 ‰; Fig. 2b). 용존산소는 표층에서 160–240 µmol L-1, 저층에서 52–220 µmol L-1의 범위를 보이며 전반적으로 표층에서 높은 값을 보였다(Fig. 2c). 저층 용존산소는 5월부터 감소하기 시작하여 8월에 최저값을 보였고(52 µmol L-1)11월에 회복되었다(190 µmol L-1). 수층 메탄농도는 표층에서 12–35 nM, 저층에서 17–230 nM의 범위를 보이며 11월을 제외하고는 전반적으로 저층이 높은 경향을 보였다(Fig. 2d). 이는 8월에 최대 농도(표층: 35 nM; 저층: 230 nM)를 보이며 증가한 메탄은 11월에 감소하였다(Fig. 4a; Table 1).
Table 1.
Sediment-water methane flux (Fsw) and air-sea methane flux (Fas) in Jinhae Bay. Cs and Cb designate observed surface methane and bottom methane concentrations, respectively. The positive value of Fas refers to CH4 moving from sea to the atmosphere
퇴적물 내 용존산소 및 황화수소의 수직분포
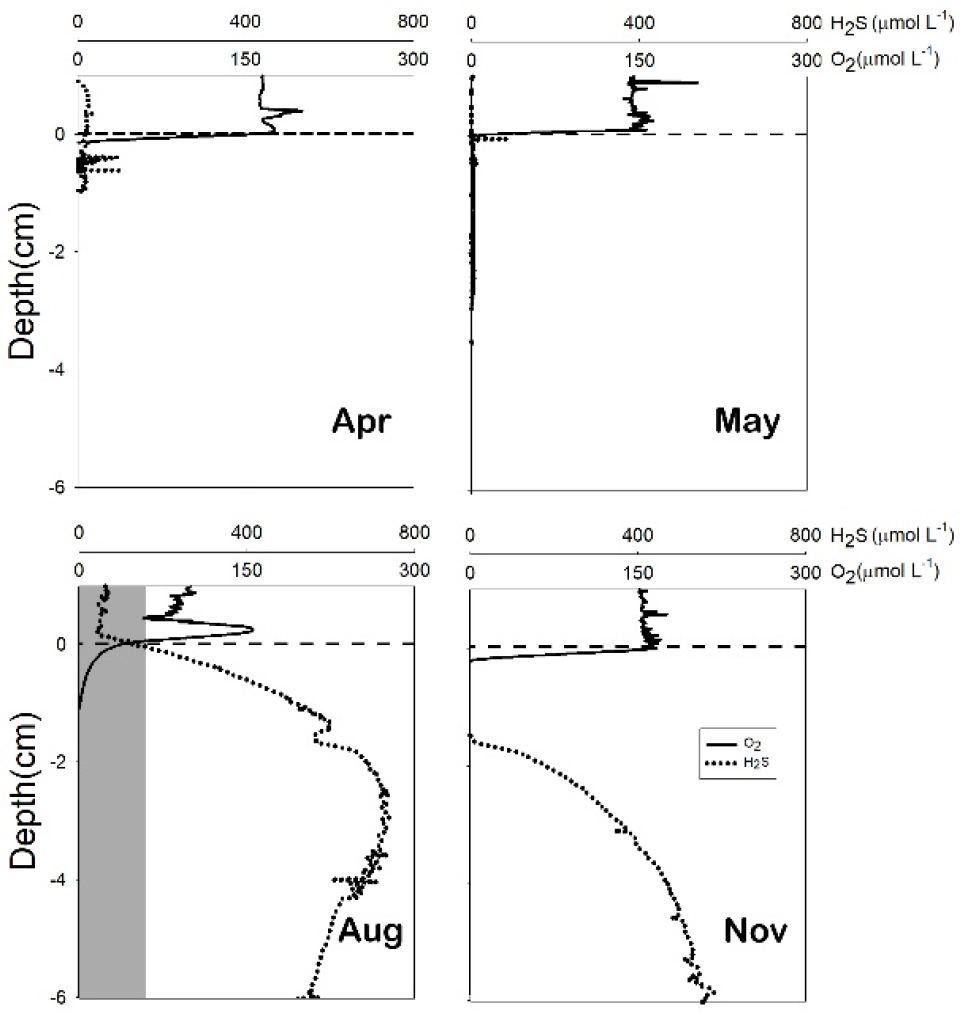
깊이별 용존산소는 빈산소가 아닌 계절에 140–170 µmol L-1 내외의 농도를 나타내고 빈산소 시에는 34 µmol L-1의 값을 보였다(Fig. 3). 산소투과 깊이는 빈산소 전 0.18 cm 내외를 유지하다 빈산소 시에는 0.9 cm로 다소 깊어졌다. 깊이별 황화수소 농도는 빈산소가 아닌 시기에는 낮은 값을 유지하였으나 빈산소 시기에는 높은 값(최대 740 µmol L-1)을 보였다(Fig. 3). 퇴적층에서 황화수소가 검출되는 깊이와 최대 농도를 보이는 깊이도 빈산소 시기 동안(8월) 얕아져(각 0 cm, 2.4 cm) 표층 가까이 상승하였으며 이는 11월까지 지속되었다(각 1.4 cm, 8 cm).
진해 당동만의 산소 및 메탄 flux 변화
퇴적층-수층간 산소 flux는 10–65 µmol m-2 d-1의 범위를 나타냈는데, 빈산소가 시작되는 5월에 비해 빈산소 시기인 8월에 감소하는 경향을 보였다 (Fig. 4b). 빈산소가 해소된 11월에는 다시 증가하는 경향을 보였다. 퇴적층-수층간 메탄 flux는 빈산소 전에는 낮은 값(0.49–12 µmol m-2 d-1)을 유지하다가 빈산소 시작 시기에 대폭 증가(1900 µmol m-2 d-1)하여 뚜렷한 계절적 차이를 보였다(Fig. 4b; Table 1). 수층-대기간 메탄 flux는 110–420 µmol m-2 d-1의 범위를 보이며 빈산소 시기 증가하였다가 빈산소 이후 감소하는 양상을 보였다(Fig. 4b; Table 1).

Fig. 4.
(a) Surface and bottom water oxygen (left-hand vertical scale, circle, and dotted line). CH4 concentrations (right-hand vertical scale, triangle, and solid line). (b) Sediment-water oxygen flux (left-hand vertical scale, x, and solid line). CH4 flux (right- hand vertical scale, inverted triangle, and dotted line). The shadow area indicates the time when hypoxia was maintained (An’s bowl, Lee et al. 2017)
4. 토 의
빈산소 형성에 따른 shoaling 양상 변화
진해만은 담수 유입이 적어 염분이 높게 유지되는 지역으로써, 빈산소를 일으키는 성층 형성은 염분보다는 표·저층의 수온 차이에 생겨난다(Lee et al. 2017). 따라서 표층 수온이 상승하여 표·저층간 수온차가 벌어지는 5월에 빈산소가 형성되기 시작한다(Kim et al. 2012; Lee et al. 2017). 2019년 진해만 수온분포 또한 5월에 표층 수온이 상승했으며, 이는 성층의 기준인 표-저층 수온차가 3℃ 이상으로 증가하며 성층의 형성을 나타냈다(Fig. 2a). 성층은 8월까지 유지되었으며 11월에 완전 해소되었다. 저층의 용존 산소는 수온 약층이 형성되는 5월부터 감소하였으며 8월에는 빈산소 추정 기준인 63 µmol L-1 이하로 떨어져 최소농도를 보였다. 따라서 2019년 진해만에서 예년과 유사한 여름철 빈산소의 형성과 해소 사이클이 진행되었음을 알 수 있었다(Fig. 4a, Lee et al. 2017).
본 연구의 목적은 빈산소에 따른 퇴적물 내 혐기층의 shoaling 형성 여부를 확인하고 이에 따른 메탄 플럭스의 변화를 정량화하는 것이다. 따라서 빈산소 시기 퇴적층 산소투과깊이(oxygen penetration depth, Zmax)의 감소와 퇴적층 내 황화수소 최대층의 심도 변화를 통해 퇴적층 shoaling여부를 판단하고자 하였다. 퇴적층 내 산소투과깊이는 퇴적층 내 산화층의 두께로써 저층수 산소의 이류·확산을 포함한 퇴적층 내 유기물의 호기성 유기물 분해 및 혐기성 과정에서 생성된 환원물질의 재산화에 의해 결정된다(Cai and Sayles 1996; Lee et al. 2003). 빈산소 시기에는 일반적으로 수층에서 퇴적층으로 유입되는 산소가 감소하여 퇴적층 산소투과 깊이가 얕아진다(Lichtschlag et al. 2015). 이는 퇴적층 내 산화층의 두께 감소를 뜻하며 따라서 혐기성 유기물 분해가 일어나는 구역의 shoaling이 발생할 수 있다.
그러나 본 연구에서는 빈산소 시기 퇴적층 산소투과깊이가 오히려 다소 증가하는 경향을 보였는데 (Fig. 3, Aug) 이는 유속의 증가로 인한 산소의 공급 증가 또는 퇴적층에서의 산소 소비의 감소에 의해서인 것으로 추정된다(Higashino and Stefan 2011). 유속의 증가는 공극수 내 용존산소의 확산을 증가시켜 산소투과깊이를 증가시킬 수 있다(Higashino et al. 2009). 빈산소 시기 진해만은 연 평균값에 비해 두 배 가량의 높은 유속을 보였는데(16 cm sec-1, 7.8 cm sec-1; 기상청 2019) 이는 진해만의 전반적인 수층 유동이 이 시기에 증가함을 지시하며 깊어진 퇴적층 산소투과깊이의 원인이 될 수 있다. 두 번째 요인은 퇴적층 산소소모의 감소인데 진해만에서 측정한 퇴적층 산소소모율은 빈산소 시기에 1/10정도로 떨어지는 등 큰 감소를 보이며(Fig. 4b, solid line; 각 6.2*10-1 mmol m-2 d-1; 3.8–5.1*10-3 mmol m-2 d-1) 이에 따라 퇴적층 산소투과깊이는 증가될 수 있다(Steinberger and Hondzo 1999; Higashino and Stefan 2011). 산소투과깊이는 수층의 용존산소뿐만 아니라 유속과 퇴적층 산소소모율에 영향을 받아 변화하므로 진해만에서 산소투과깊이의 변화로 shoaling여부를 판단하기는 어려웠다. 전반적으로 산소농도가 낮아진 빈산소 시기에 산소 투과 깊이는 유기물 분해의 강도나 혐기층 깊이를 가늠하기에는 좋은 지시자가 아닌 것으로 판단된다.
황화수소는 퇴적층 내 대표적인 혐기성 유기물 분해과정 중 하나인 황산염 환원을 통해 생성되기에 퇴적층에서 황화수소가 발견되는 구간은 황산염 환원 구간을 간접적으로 보여준다(Marvin-DiPasquale et al. 2003). 황산염 환원 과정의 산물인 황하수소는 산소는 물론 산화된 형태의 철에 의해서도 쉽게 산화가 일어나므로 황하수소 농도의 최대층이 얕아진 것은 퇴적물표층에 황화수소를 산화시킬 수 있는 물질의 공급이 감소했다는 것을 의미하며 전반적인 혐기성과정의 shoaling을 지시할 것이다. 빈산소 전(4, 5월) 퇴적층 내 황화수소 농도의 최대값은 6 cm 이상의 깊은 곳에 존재하였으나 빈산소 시기(8월)에는 2.4 cm로 상승하였다(Fig. 3). 이러한 황화수소 산화환경의 변화는, 메탄생성을 포함한 전반적인 혐기성 과정이 좀더 표층 가까이로 상승하여 shoaling 되었을 가능성을 시사하여 준다.
11월 수층의 빈산소는 해소되었음에도 불구하고 퇴적물 내 공극수 황화수소농도는 퇴적물 표층 3 cm부터 높은 농도를 유지하고 있어, 빈산소 시기에 축적된 혐기성호흡 산물이 해소되지 않았음을 나타냈다. 즉 산소부채(oxygen debt)가 해소되는데 시간이 걸려 수층은 빈산소가 해소되었으나 퇴적층은 산소부채가 해소되지 못했음을 나타낸다. 산소부채란 혐기성 유기물 분해과정에서 생성되어 축적된 부산물(Oxygen Demand Units; ODUs; NH4+, H2S, FeS; Soetaer et al. 1996)을 재산화시키기 위해 필요한 산소가 아직 충분히 공급되지 않아 혐기성 호흡의 산물이 해소되지 않고 남아있음을 의미한다(Pamatmat 1971). 일반적으로 산소부채는 빈산소가 발생하는 여름철 생성된 후 가을에서 늦봄 사이 해소된다(Martens and Klump 1984; Chanton et al. 1987; Boynton et al. 1991; Rasmussen and Jørgensen 1992; Moeslundi et al. 1994; Brady et al. 2013; Seitaj et al. 2017). 황화수소 또한 빈산소 시 일시적으로 황화철의 형태(FeS; Jørgensen 1977) 혹은 황철석(FeS2, pyrite)형태로 변환되어 퇴적층에 축적되며 산소부채의 원인이 된다(Boesen and Postma 1988; Raiswell and Canfield 2012; Lukawska-Matuszewska et al. 2019). 형성된 산소부채는 빈산소의 해소시 재산화되면서 황산염을 형성할 수 있고 생성된 황산염은 현장(in situ)의 황산염 환원 과정에 재사용되기도 한다. 따라서 11월에 퇴적층 얕은 구간에서 검출된 황화수소 농도는 산소부채의 해소 과정에서 2차적으로 생성된 황화수소일 가능성도 있다(Luther et al. 1982; Thamdrup et al. 1994).
빈산소에 의한 퇴적층-수층 플럭스 와 수층-대기 플럭스 변화
메탄생성구간의 shoaling은 메탄의 생성과 소비를 변화시킬 수 있다. 메탄의 생성 증가는 메탄생성구간으로 유입되는 유기물이 증가됨으로써 발생한다. 수층에서 퇴적층으로 유입되는 유기물은 여러 산화제에 의해 분해되며 퇴적층 내 깊은 구간까지 가는 도중 대부분이 제거된다(Torres-Alvarado et al. 2005). 메탄 생성은 유기물의 혐기성 분해과정 중 최종단계이기 때문에 퇴적층의 가장 깊은 곳에서 일어나며(Reeburgh 2007) 따라서 메탄생성구간의 유기물의 유입은 부족한 편이다. 그러나 shoaling이 발생할 경우 수층과 메탄생성구간 사이의 거리가 짧아져 메탄생성구간으로 유입되는 유기물이 증가하고, 결과적으로 메탄생성이 증가될 수 있다(Fig. 5).
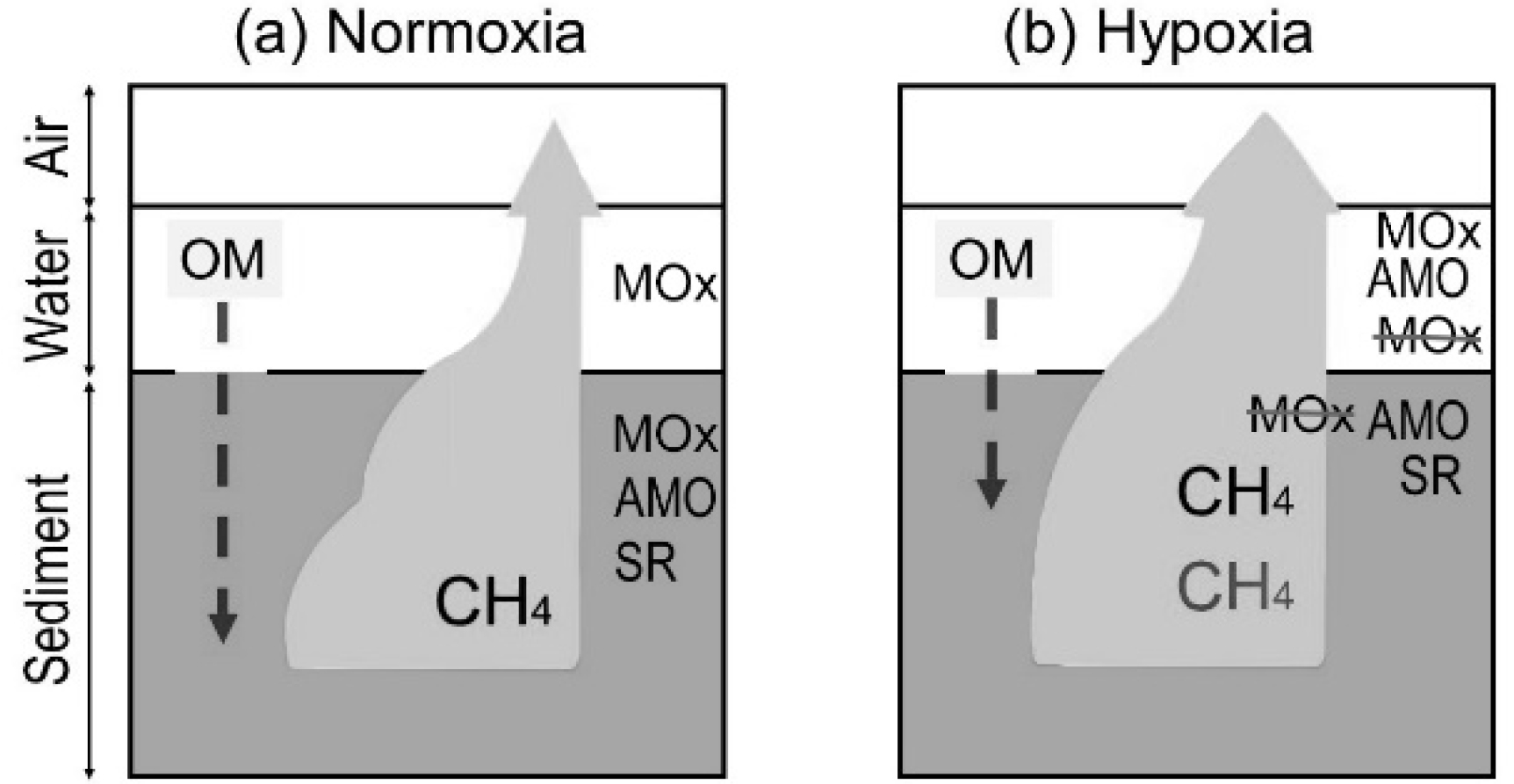
Fig. 5.
Methane production and oxidation change during normoxia (a) and hypoxia (b). OM (organic matter) (dotted arrow) indicates the organic matter supply route. CH4 indicates the depth in which CH4 production occurs. The shadow arrow indicates the CH4 flux. SR indicates the depth in which sulfate reduction occurs. AMO indicates the depth, where anaerobic oxidation of CH4 occurs. MOx (Aerobic oxidation of methane) indicates the depth, where aerobic oxidation of CH4 occurs
퇴적층에서 생성된 메탄은 수층으로 이동하는 도중 혐기성 혹은 호기성 메탄 산화에 의해 감소한다(Torres- Alvarado et al. 2005). shoaling으로 인해 감소한 메탄생성구간과 수층 사이의 거리는(Fig. 5, black arrow) 메탄의 소비를 감소시킬 수 있다. 또한 빈산소는 퇴적층으로 유입되는 산소를 감소시켜 메탄의 호기성 산화를 저해시킬 수 있다. 실제로 진해만에서 호기성 미생물의 활동을 나타내는 퇴적층 산소소모율은 빈산소 시기 10배 이상 낮은 값을 보였다(Fig. 4b, solid line; Table 1). 빈산소 시기 퇴적층에서의 메탄산화 미생물 군집의 분포 또한 낮은 값을 보였다(Park et al. 2020).
빈산소 시기 퇴적층에서의 메탄의 생성 증가와 소비 감소는 퇴적층-수층 메탄 flux의 증가, 나아가 수층의 용존 메탄 농도 증가를 일으킬 수 있다(Fig. 5, shadow arrow). 진해만의 퇴적층-수층간 메탄 flux는 빈산소 발생 전 6 µmol m-2 d-1, 빈산소 시1900 µmol m-2 d-1의 값을 보이며 300배 이상의 증가를 보여주었다(Fig. 4b, dotted line; Table 1). 이는 빈산소에 의한 shoaling의 영향 때문인 것으로 생각되며 저층수 메탄농도 또한 용존산소와 강력한 음의 상관관계를 보였다(Fig. 4a; R2 = 0.8269). 따라서 빈산소 현상에 의한 생성과 소비의 변화가 퇴적층-수층 메탄 flux를 증가시켜 결과적으로 수층 메탄 농도 증가의 원인이 되었을 것이다 (Bange et al. 2010).
빈산소 시기 동안 수층-대기 메탄 flux또한 빈산소에 의해 영향을 받을 가능성이 높은데, 이는 퇴적층에서의 메탄 공급 증가와 수층에서의 메탄 소비 감소가 복합적으로 작용할 수 있기 때문이다(Fig. 5b, shadow arrow; Bange et al. 2010). 수층메탄은 주로 호기성 메탄산화(Aerobic Reduction, AR)에 의해 감소하는데 호기성 메탄 산화의 효율은 메탄과 용존산소의 농도, 수온, 염분, 수괴의 특성 등에 의해 좌우된다(Fig. 5a, AR; Torres-Alvarado et al. 2005; Steinle et al. 2017). 한편 빈산소 시기에 오히려 수층에서의 호기성 메탄 산화가 증가할 가능성도 최근에 보고되었는데, 용존산소가 감소하면, 메탄산화를 일으키는 고세균의 포식압이 감소하고 개체수가 보존될 가능성이 높아지며, 메탄산화 고세균은 신진대사적으로 산소 이외의 다른 경로를 사용하여 메탄을 산화하기 때문에 빈산소 시 오히려 메탄산화가 증가할 것이라는 보고가 있었다(Steinle et al. 2017). 그러나 진해만의 경우 용존산소가 감소하면서 호기성 메탄 산화 고세균 군집의 감소가 보였고(Park et al. 2020) 이는 빈산소의 발생시 수층메탄의 호기성 산화가 감소하였음을 암시한다(Fig. 5, AR).
진해만 수층-대기 메탄 플럭스 평가
진해만의 수층-대기간 메탄 flux는 110–420 µmol m-2 d-1의 범위를 보였으며, 연 평균값은 250 µmol m-2 d-1로 2–1300 µmol m-2 d-1사이의 값을 보이는 연안 메탄 범위 내에 속하였다. 빈산소 시기 수층-대기간 메탄 flux값은 420 µmol m-2 d-1로 빈산소가 일어나기 전과 비교하였을 때 2배 이상 높으며 이는 인근지역에 위치하며 담수의 영향을 받는 낙동강의 메탄 flux보다도 2배 정도 높은 값이다(Table 2). 이렇듯 진해만에서 나타난 빈산소시기 높은 메탄 flux는 앞서 언급한 퇴적층에서의 생성 증가와 생성된 메탄의 소비 감소로 증가한 표층 메탄이 높은 풍속에 의해 대기로 방출되면서 나타난 결과일 것이다.
본 연구에서는 성층이 해소되는 시기에 수직적 메탄 농도와 수층-대기 메탄 flux를 측정하지 못하여 빈산소 시기 축적된 메탄의 방출 또는 산화 여부를 직접적으로 고려하지 못하였다. 그러나 빈산소 시기 수직적 메탄농도와 빈산소 해소 시기 수층미생물 군집변화를 통해 성층이 해소된 후 메탄의 거동을 추정할 수 있었다. 진해만에서 빈산소 시기 수층으로 이동한 메탄은 성층의 형성으로 인해 대기로 전부 방출되지 못하고 저층수에 축적됨을 보였다(Fig. 2d, 14 m). 축적된 메탄의 호기성 산화 여부는 수층에 존재하는 메탄산화 미생물 군집의 변화를 통해 확인하였는데, 메탄산화 미생물 군집은 빈산소 발생 이후 더 낮은 경향을 보였다(Park et al. 2020). 따라서 빈산소 시기 저층에 축적된 메탄이 산화되지 못할 것이라 추정되며, 이는 성층이 해소될 때 대기중으로 방출되어 빈산소에 의해 변화하는 메탄 budget에 큰 영향을 끼칠 것이라 생각된다. 따라서 우리가 측정한 빈산소에 따른 메탄 budget변화는 과소평가되었을 가능성이 크다(Bange et al. 2010; Gelesh et al. 2016).
Table 2.
Air-sea methane fluxes (Fas) and surface methane concentrations from Jinhae Bay and various coastal areas. Numbers in the parenthesis are averaged values. Kw was estimated using the equation of Liss and Merlivat (1986)a, Wanninkhof (1992)b, Clark et al. (1995)c
| Study Area | Month |
Sur. CH4 (nM) |
Fwa (µmol m-2 d-1) | Reference |
| Tomales Bay | Every | 8–100 | 7–10 | Sansone et al. (1998) |
| Columbia Estuary | Aug. | 2–120 | Sansone et al. (1999) | |
| Oregon Estuaries | Over 4 years | 6–695 | 2–1,309 (181) | De Angelis and Lilley (1987) |
| Hudson Estuary | Mar., Aug. | 349 | De Angelis and Scranton (1993) | |
| Tyne Estuary | Jan. | 14–654 (164) | Upstill-Goddard et al. (2000) | |
| European Estuaries | Feb., Apr.–Jul., Sep.–Dec. | 4–1,437 | (130) | Middelburg et al. (2002) |
| Danube Estuaries | Jul.–Aug. | (131) | (260)a, (470)b | Amouroux et al. (2002) |
| Pulicat Lake | Dec. | 94–501 (242) | (54)a, (280)b, (180)c | Shalini et al. (2006) |
| Changjiang Estuary | Apr.–Jun., Aug., Oct.–Nov. | 3–89 | 3–146 | Zhang et al. (2008) |
| Nakdon Estuary | Jan., Sep., Nov. | 21–436 (189) | 23–650 (225) | Ryu and An (2016) |
| Jinhae Bay | Average | 2–35 (23) | 110–420 (250) | This study |
| Apr., May., Nov. (Non-Hypoxia) | 12–22 (18) | 110–250 (190) | ||
| Aug., (Hypoxia) | 35 | 420 |